题目内容
【题目】在恒温密闭容器中制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)MgO(s)+CO2(g)+SO2(g)﹣Q,达到平衡后,以下分析正确的是( )
A.加入硫酸镁固体,平衡正向移动
B.达到平衡时,气体的平均分子量保持不变
C.保持体积不变,充入CO,达到平衡的过程中逆反应速率逐渐增大
D.1mol MgSO4和1mol CO反应,达到平衡时吸收热量为Q
【答案】BC
【解析】
A.反应中,固体量的增减不会引起化学平衡的移动,所以加入硫酸镁固体,平衡不移动,故A错误;
B.根据气体的平均分子量M=![]() ,质量变化,n也变化,当M不变了,达到了平衡,故B正确;
,质量变化,n也变化,当M不变了,达到了平衡,故B正确;
C.增大反应物的浓度,反应速率加快,正逆反应速率迅速加快,逆反应速率在原来基础上加快,故C正确;
D.可逆反应的特点:不能进行彻底,所以1mol MgSO4和1mol CO反应,达到平衡时吸收热量小于Q,故D错误;
故答案为BC。

 阅读快车系列答案
阅读快车系列答案【题目】金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶性金属氢氧化物在不同pH下的溶解度[S(mol·L-1)]如图所示。
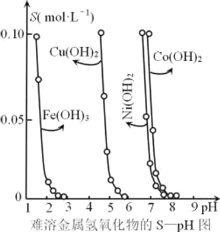
(1)pH=6时溶液中铜元素的主要存在形式是________。
(2)若要除去CuCl2溶液中的少量Fe3+,下列最适宜的pH 范围是_____(选填序号)。
A.<2 B. 3.54.2 C. >6.3
(3)在Ni(OH)2溶液中含有少量的Co2+杂质,_______(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是______.
(4)可用加入氨水的方法使Cu(OH)2沉淀溶解,生成的产物之一为[Cu(NH3)4]2+。该反应的离子方程式为______.
已知一些难溶物的溶度积常数如下表:
物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-36 | 3.4×10-28 | 6.4×10-53 | 1.6×10-24 |
(5)某工业废水中含有Cu2+、Pb2+、Hg2+,为除去这些离子,最适宜向此工业废水中加入过量的______(选填序号)。
A.NaOH B.FeS C.Na2S
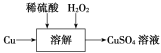
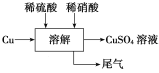
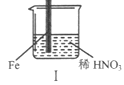
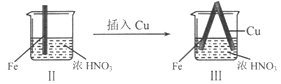
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化