题目内容
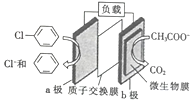
【题目】高温时通过以下反应制备金属铝。用铝制作的“快速放电铝离子二次电池”的原理如下图所示(EMI+为有机阳离子)。

①Al2O3(s)+AlCl3(g)+3C(s) = 3AlCl(g)+3CO(g) △H1= a kJ·mol-1
②3AlCl(g) = 2Al(l)+ AlCl3(g) △H2= b kJ·mol-1
③Al2O3(s)+3C(s) = 2Al(l)+3CO(g) △H3
下列说法正确的是
A.该电池的电解质可用氯化铝水溶液替代
B.Al2O3(s)+3C(s) = 2Al(l)+3CO(g) △H3= (a-b) kJ·mol-1
C.该电池充电时石墨电极与电源正极相连
D.该电池放电时的负极反应方程式为 :Al-3e-+7AlCl4-=4Al2Cl7-
【答案】CD
【解析】
A.该电池在无水条件下进行,电解质不可用氯化铝水溶液替代,高温时氯化铝水溶液水解生成氢氧化铝,故A错误;
B.根据盖斯定律Al2O3(s)+3C(s)=2Al(l)+3CO(g)为①+②,所以Al2O3(s)+3C(s)=2Al(l)+3CO(g)△H3=(a+b)kJ·mol-1,故B错误;
C.充电时正极与外接电源的正极相连,则石墨极与外电源的正极相连,故C正确;
D.放电时,铝是活泼的金属铝是负极,铝发生氧化反应生成铝离子,铝离子与AlCl4-结合生成Al2Cl7-,所以电极反应式为:Al-3e-+7AlCl4-═4Al2Cl7-,故D正确;
故选CD。

【题目】磁性材料产业是21世纪各国竞相发展的高科技支柱产业之一,磁性材料广泛用于电子信息、军事技术等领域。碳酸锰主要用于制备软磁铁氧体,工业上用氯化铵焙烧锰矿粉制备高纯度碳酸锰的工艺流程如下:
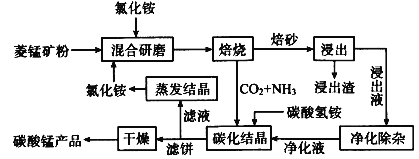
已知:①锰矿粉的主要成分是MnCO3,还含少量Fe、Al、Ca、Mg等元素。
②相关金属Mn+离子c(Mn+)=0.1molL -1形成M(OH)n沉淀的pH范围如下:
金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ | Ca2+ | Mn2+ |
开始沉淀的pH | 1.5 | 3.8 | 6.3 | 9.6 | 10.6 | 8.8 |
沉淀完全的pH | 2.8 | 5.2 | 8.3 | 11.6 | 12.6 | 10.8 |
回答下列问题:
(1)“焙烧”时发生的主要反应的化学方程式为___。
(2)浸出液“净化除杂”过程如下:①加入MnO2将Fe2+氧化为Fe3+;②__将Al3+、Fe3+变为沉淀除去;③加入NH4F将__离子沉淀除去。写出反应①的离子方程式为___;
(3)碳化结晶时,反应的离子方程式为___。
(4)碳化结晶过程中不能用碳酸铵溶液代替碳酸氢铵溶液可能的原因是__。流程中能循环利用的物质除了氯化铵之外还有__。
(5)测定碳酸锰产品的纯度。
称取0.5000g碳酸锰产品于锥形瓶中,加25.00mL磷酸,加热,碳酸锰全部转化为[Mn(PO4)2]3-,冷却至室温。加水稀释至100mL,滴加2~3滴指示剂,然后用浓度为0.2000mol·L-1的硫酸亚铁铵[(NH4)2Fe(SO4)2]标准溶液滴定(反应为:[Mn(PO4)2]3- +Fe2+=Mn2+ +Fe3++2PO43-)。重复操作3次,记录数据如下表:
滴定次数 | 0.2000mol·L-1的硫酸亚铁铵标准溶液读数(mL) | |
滴定前 | 滴定后 | |
1 | 0.10 | 20.20 |
2 | 1.32 | 21.32 |
3 | 1.05 | 20.95 |
则产品的纯度=__,若滴定终点时发现滴定管尖嘴处产生了气泡,则测得的碳酸锰粗产品的纯度__(填“偏高”“偏低”或“无影响”)。