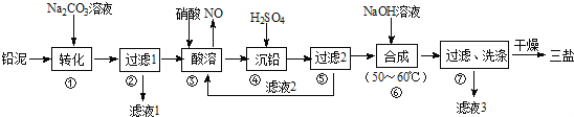
题目内容
【题目】前四周期的A、B、C、D四种元素在周期表中均与元素X紧密相邻.已知元素X最高价氧化物的化学式为X2O5,B、D同主族且B元素的原子半径是同族元素中最小的,C的最高价氧化物对应的水化物是强酸.
(1)D元素基态原子的电子排布式为____________.
(2)A、C、X三种元素原子的第一电离能由大到小的顺序为_______________(用相应的元素符号作答).
(3)B、X、D氢化物的沸点由高到低的顺序为_______________(用相应的化学式作答).
(4)E元素是A元素所在周期中电负性最大的,试推测下列微粒的立体构型:
微粒 | EO2﹣ | EO3﹣ |
立体构型名称 |
(5)元素B的一种氢化物B2H4具有重要的用途.有关B2H4的说法正确的是____________.
A.B2H4分子间可形成氢键 B.B原子是sp3杂化
C.B2H4分子中含有5个σ键和1个π键 D.B2H4晶体变为液态时破坏共价键
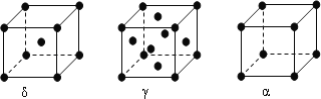
(6)F元素基态原子M层上有5对成对电子,F形成的单质有δ、γ、α三种同素异形体,三种晶胞(如图所示)中F原子的配位数之比为____________,δ、γ、α三种晶胞的边长之比为____________。
【答案】(1)1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3(2)P>S>Si
(3)NH3>AsH3>PH3(4)V形;三角锥形(5)AB (6)4:6:3,![]()
【解析】
试题分析:元素X最高价氧化物的化学式为X2O5,则X为第ⅤA族元素,前四周期的A、B、C、D均与元素X紧密相邻,即位于X的四周,则A、B、C、D位于元素周期表的第二、三、四周期,X为P元素,B、D同主族且B元素的原子半径是同族元素中最小的,B、X、D同主族,则B为N元素,D为Sn元素,C的最高价氧化物对应的水化物是强酸,C为S元素,A为Si元素。
(1)D是Sn元素,原子序数为33,其基态原子的电子排布式为1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3;
(2)A、C、X分别为Si、S、P,根据元素周期律,同周期元素从左向右,第一电离逐渐增大,但第ⅡA族和第ⅤA族由于最外层处于全满和半满状态,第一电离能高于相邻族的元素,所以Si、S、P的第一电离能大小顺序为P>S>Si;
(3)B、X、D氢化物分别为NH3、PH3、AsH3,因为氨分子之间有氢键的存在,所以氨的沸点较大,则AsH3>的相对分子质量大于PH3,所以沸点也高于PH3,所以它们的沸点由高到低的顺序为NH3>AsH3>PH3;
(4)EO2-为ClO2-,EO3-为ClO3-,它们的中心原子氯原子的价层电子对数均为(7+1)/2=4,所以氯原子都是sp3杂化,在ClO2-中有两个Cl-O键,所以ClO2-的空间构型为V形,而在ClO3-中有三个Cl-O键,所以ClO3-的空间构型为三角锥形;
(5)B2H4为N2H4,A.N2H4分子间与NH3相似,可形成氢键,A正确;B.N2H4分子中N原子的价层电子对数为(5+1+1+1)/2=4,所以氮原子是sp3杂化,B正确;C.N2H4分子中N原子之间是单键,所以没有π键,C错误;D.N2H4是分子晶体,所以晶体变为液态时破坏的是分子间作用力和氢键,D错误;答案选AB;
(6)F元素基态原子M层上有5对成对电子,则F的核外电子排布式为1s22s22p63s23p63d64s2,所以F为Fe元素;δ晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于晶胞的体心,补全晶胞可知配位数为8,γ晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于面心上,补全晶胞可知,有3层,每层有4个,故Fe原子的配位数为4×3=12。α晶胞中,以顶点Fe原子研究,与之最近的Fe原子处于所在棱的顶点上,补全晶胞可知配位数为6,所以δ、γ、α三种晶胞中Fe原子的配位数之比为4:6: 3;设铁原子的直径为a,根据晶胞结构图可知,δ晶胞的边长为![]() 、γ晶胞的边长为
、γ晶胞的边长为![]() 、α晶胞的边长为a,所以δ、γ、α三种晶胞的边长之比为:
、α晶胞的边长为a,所以δ、γ、α三种晶胞的边长之比为:![]() :
:![]() :a=
:a=![]() 。
。

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案