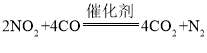题目内容
【题目】硫代硫酸钠(Na2S2O3)在生产生活中具有广泛应用。回答下列问题:
I.工业上普遍使用Na2SO3与硫磺共煮制备Na2S2O3,装置如图1。
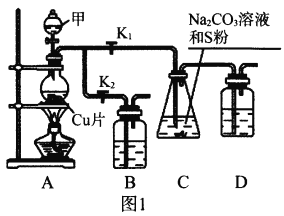
(1)打开K1关闭K2,向圆底烧瓶中加入足量试剂甲并加热。试剂甲为_________,装置B和D的作用是_________。
(2)始终保持C中溶液呈碱性、加热产生Na2S2O3,反应的化学方程式为___________________________。反应一段时间后,C中硫粉逐渐减少,及时打开K2、关闭K1并停止加热,将C中所得混合物分离提纯后即得到Na2S2O3。若不及时关闭K1,将导致C中溶液呈酸性、发生副反应产生S和_________。
Ⅱ.利用SO2与Na2CO3、Na2S的混合溶液反应也能制备Na2S2O3,所需仪器如图2。
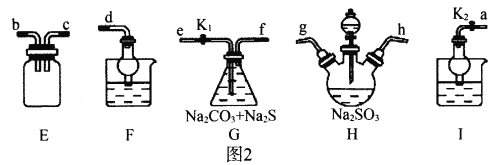
(1)装置G中Na2CO3与Na2S的最佳物质的量之比为_________。
(2)从左到右连接各仪器,接口顺序为:_________接g、h接_________、_________接_________、_________接d。
Ⅲ.常用Na2S2O3溶液测定废水中Ba2+浓度。
取废水20.00mL,控制适当的酸度加入足量K2Cr2O7溶液,得 BaCrO4沉淀;过滤洗涤后用适量稀酸溶解,此时CrO42-全部转化为Cr2O72-;再加过量KI溶液,将Cr2O72-充分反应:Cr2O72-+6I-+14H+=3I2+2Cr3++7H2O。然后加入淀粉溶液作指示剂,用0.0100mol/L的Na2S2O3溶液进行滴定:I2+2S2O32-===S4O62-+2I-。当溶液_________即为终点。平行滴定3次,消耗Na2S2O3溶液的平均用量为18.00m,则该废水中Ba2+的物质的量浓度为_________。
【答案】浓硫酸 吸收SO2,防止污染空气 S+SO2+Na2CO3![]() Na2S2O3+CO2 NaHSO3 1:2 a b c e f 蓝色褪去且在半分钟内不恢复 0.00300mol/L
Na2S2O3+CO2 NaHSO3 1:2 a b c e f 蓝色褪去且在半分钟内不恢复 0.00300mol/L
【解析】
I.(1)A为二氧化硫的制备装置,C制取Na2S2O3,二氧化硫有毒,装置B和D中需盛碱液(如NaOH溶液),用于吸收SO2,防止污染空气。
Ⅱ.(1)装置G中Na2CO3与Na2S的最佳物质的量之比由反应方程式中化学计量数之比确定;
(2)按I(实验后期关闭K1,打开K2可吸收多余SO2)→H(制取SO2)→E(安全装置)→G(制取Na2S2O3)→F(吸收SO2尾气)确定连接装置的顺序。
Ⅲ.碘遇到淀粉呈蓝色,终点为蓝色褪去且在半分钟内不恢复;
按关系式:2Ba2+~2BaCrO4~Cr2O72-~3I2 ~6S2O32-计算n(Ba2+),再由C=n/V计算浓度。
I.(1)A为二氧化硫的制备装置,故试剂甲为浓硫酸,装置B和D中需盛碱液(如NaOH溶液),用于吸收SO2,防止污染空气。
(2)C中反应物SO2、Na2CO3溶液和硫粉,根据题意首先SO2和Na2CO3溶液发生反应生成Na2SO3和CO2,Na2SO3和S制Na2S2O3,总反应为:S+SO2+Na2CO3![]() Na2S2O3+CO2;
Na2S2O3+CO2;
若不及时关闭K1,将导致C中溶液呈酸性而发生副反应Na2S2O3+SO2+H2O=2NaHSO3+S↓。
Ⅱ(1)装置G中发生反应的方程式为:Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2,故Na2CO3和Na2S的最佳物质的量之比为1:2。
(2)需按下列顺序连接装置,I(实验后期关闭K1,打开K2可吸收多余SO2)→H(制取SO2)→E(安全装置)→G(制取Na2S2O3)→F(吸收SO2尾气),所以各接口的顺序为:a接g、h接b、c接e、f接d。
Ⅲ向碘的淀粉蓝色溶液中滴加Na2S2O3溶液,滴定终点为蓝色褪去且在半分钟内不恢复。
相关物质转化的关系式为:2Ba2+~2BaCrO4~Cr2O72-~3I2 ~6S2O32-,n(Ba2+)=n(S2O32-)/3=18.00mL×0.0100mol/L/3=0.06mmol,c(Ba2+)=0.06mmol/20.00mL=0.00300mol/L