题目内容
3.溶液在25℃时由水电离出氢离子的浓度为1×10-12 mol•L-1,下列说法正确的是( )| A. | 该溶液pH=12 | B. | 该溶液pH=2 | C. | 该溶液pH=12或2 | D. | 不能确定溶液pH |
分析 根据水电离出的c(H+)=1×10-12 mol/L,水的电离受到抑制,该溶液可能为酸或碱或盐的溶液;据此选择即可.
解答 解:A、由水电离出氢离子的浓度为1×10-12 mol•L-1,水的电离受到抑制,可能为强酸溶液,此时氢离子浓度等于10-2,pH=2,故A错误;
B、由水电离出氢离子的浓度为1×10-12 mol•L-1,水的电离受到抑制,可能为强碱溶液,此时氢离子浓度等于1×10-12,pH=12,故B错误;
C、依据AB的分析可知,此时溶液pH=12或2,故C正确;
D、依据25℃时水的离子积为10-14,可以计算pH值,故D错误,故选C.
点评 本题考查水电离出的氢离子浓度为1×10-12mol/L的溶液,则溶液可能为酸或碱或盐的溶液,明确由水电离出的氢离子浓度及利用该信息来分析问题是解答的关键,难度较小.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.对于某些离子的检验及结论一定正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| B. | 加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入NaOH溶液并加热,产生的气体能使湿润的蓝色石蕊试纸变红,一定有NH4+ | |
| D. | 在试样中先加入HCl无明显现象,再滴加BaCl2,若生成白色沉淀,试样中有SO42- |
8.已知阿伏加德罗常数为NA,下列说法正确的是( )
| A. | 2mol水中含有NA个H2O分子 | |
| B. | 1g氢气含有NA个H2分子 | |
| C. | 2mol钠与过量稀盐酸反应生成NA个H2分子 | |
| D. | 16g氧气中含有NA个氧分子 |
12.下列有关物质的性质和该性质的应用均正确的是( )
| A. | 氨气具有氧化性,用浓氨水检验Cl2管道是否泄漏 | |
| B. | 氢氟酸具有强酸性,用氢氟酸蚀刻玻璃 | |
| C. | 碳酸氢钠热稳定性弱,用作焙制糕点的发酵粉 | |
| D. | 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸 |
13.下列各对物质属于同分异构体的是( )
| A. | ${\;}_{6}^{12}$C与${\;}_{6}^{13}$C | B. | O2与O3 | ||
| C. | 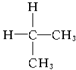 与 与 | D. | 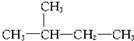 与 与 |
 有人设计了如图所示的一个电解氯化钠溶液的装置,a为饱和食盐水,X、Y是两块电极板,通过导线与直流电源相连.请回答下列问题:
有人设计了如图所示的一个电解氯化钠溶液的装置,a为饱和食盐水,X、Y是两块电极板,通过导线与直流电源相连.请回答下列问题: