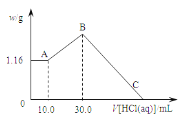
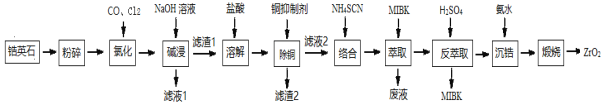
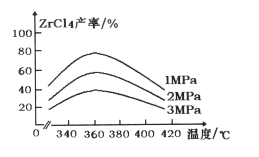
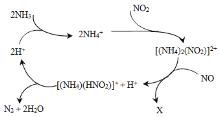
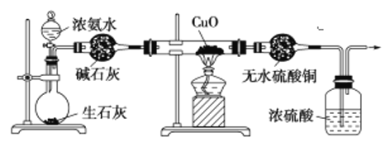
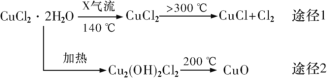题目内容
【题目】已知:废液中含+6 价铬的化合物毒性较大污染性强,常用 NaHSO3 将废液中的Cr2O72-还原成 Cr3+。请配平该反应的离子方程式:_____ Cr2O72-+_____HSO3-+____H+ = ____Cr3++_____SO42-+_____H2O
并用双线桥标出电子转移的方向和数目____________________。
【答案】1 3 5 2 3 4 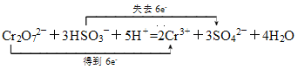
【解析】
在反应Cr2O72-+HSO3-+H+→ Cr3++SO42-+H2O中,Cr2O72-是氧化剂,HSO3-是还原剂;然后确定化合价降低和升高元素的价态变化,按化合价升高与降低总数相等的原则,配平氧化剂和还原剂,进而配平氧化产物和还原产物;再按电荷守恒、质量守恒配平其它物质;用双线桥标出电子转移的方向和数目时,应使用两条带箭头的曲线,一条从反应中的Cr出发,箭头指向生成物中的Cr,另一条从反应物中的S出发,箭头指向产物中的S。
在反应Cr2O72-+HSO3-+H+→ Cr3++SO42-+H2O中,Cr2O72-是氧化剂,HSO3-是还原剂;Cr2O72-中的Cr元素,由+6价降为+3价,Cr2O72-中Cr共降低6价;HSO3-中的S元素,由+4价升为+6价,升高2价。按化合价升高和降低的总数相等的原则配平,二者的化学计量数应为1和3,即Cr2O72-+3HSO3-,由此可确定部分产物的化学计量数,即2Cr3++3SO42-,从而得出Cr2O72-+3HSO3-+H+→ 2Cr3++3SO42-+H2O;再按电荷守恒进行配平,即得Cr2O72-+3HSO3-+5H+→ 2Cr3++3SO42-+H2O;最后按质量守恒进行配平,即得Cr2O72-+3HSO3-+5H+=2Cr3++3SO42-+4H2O。用双线桥标出电子转移的方向和数目为: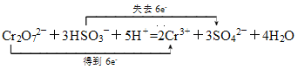 ;
;
答案为:1;3;5;2;3;4;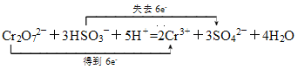 。
。

 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案