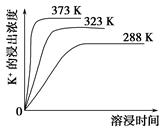
题目内容
探究小组用滴定法测定CuSO4·5H2O(Mr=250)含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol ·L-1 EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:
Cu2++H2Y2-=CuY2-+2H+
(1)写出计算CuSO4·5H2O质量分数的表达式w=_______________;
(2)下列操作会导致CuSO4·5H2O含量的测定结果偏高的是________。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
(1)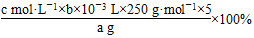 (2)c
(2)c
解析

 阅读快车系列答案
阅读快车系列答案工业上将制取重铬酸钾(K2Cr2O7)和铬酸酐(CrO3)的剩余废渣称为铬渣,其成分为SiO2、Al2O3、MgO、Fe2O3、CrO3、K2Cr2O7等。
已知:
①重铬酸钾和铬酸酐都易溶于水,这是造成铬污染的主要原因,它们都是强氧化剂,铬酸酐溶于水呈酸性;
②+6价铬易被人体吸收,可致癌;+3价铬不易被人体吸收,毒性小。
③下表为一些金属氢氧化物沉淀的pH参照数据。
| 物质 | 开始沉淀 | 完全沉淀 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| Cr(OH)3 | 4.7 | a |
| Fe(OH)2 | 7.6 | 9.6 |
| Mg(OH)2 | 9.6 | 11.1 |
回答下列处理铬渣、消除铬污染的有关问题:
(1)将铬渣用稀硫酸浸取、过滤,在浸出液中加入适量的绿矾(FeSO4·7H2O),加入绿矾的目的是_____________________________________________
(2)再向浸出液中缓慢加入烧碱,至pH刚好达到4.7,过滤,所得沉淀的化学式是____________________________________________________________;
常温下,Cr(OH)3的溶度积Ksp=10-32,要使Cr3+完全沉淀[c(Cr3+)降至10-5 mol·L-1视为沉淀完全],溶液的pH应调于a=________。
(3)向(2)中得到的滤液中加入硫酸,调节至呈强酸性,所得的溶液是含____________________溶质的溶液。
已知0.1mol/L H2SO4在水中的第一步电离是完全的,第二步电离并不完全。常温下有0.1mol/L的以下几种溶液的电离度(即已经电离的分子数占原来分子总数的百分数)如下表,回答下列问题:
| ①H2SO4溶液中的HSO4– | ②NaHSO4溶液中的HSO4– | ③CH3COOH | ④HCl溶液 |
| 10% | 29% | 1.33% | 100% |
(2)常温下,题设条件下的①溶液中c(H+)= 。
(3)常温下,pH相同的上述几种溶液,其物质的量浓度由大到小的顺序是(填序号) 。
(4)若将10mL题设条件下的NaHSO4溶液与0.1mol/LNaOH溶液等体积混合,则混合后溶液中离子浓度由大到小顺序为 。
(5)根据题设条件计算CH3COOH的电离常数Ka= 。若常温下,将b mol·L–1的CH3COONa液与0.01 mol·L–1的盐酸等体积混合,反应达平衡时,测得溶液的pH=7,用含b的代数式表示CH3COOH的电离常数Ka= 。
请回答下列问题:
(1)若分别将pH=2的盐酸和醋酸稀释100倍,则稀释后溶液的pH:盐酸 醋酸(填“>”、“=”或“<”)。
(2)将100mL 0.1mol?L-1的CH3COOH溶液与50mL 0.2mol?L-1的NaOH溶液混合,所得溶液呈 性,原因是 (用离子方程式表示)。
(3)0.1mol·mol-1的氨水溶液中存在电离平衡NH3+H2O  NH3·H2O
NH3·H2O NH4++OH-,在此平衡体系中改变条件(见下表),请完成表中空格:
NH4++OH-,在此平衡体系中改变条件(见下表),请完成表中空格:
| | 条件的变化 | 通氨气 | 加水 | 加NH4Cl(s) |
| ① | 电离平衡移动的方向 | | | |
| ② | c(OH-)的变化 | | | |
[第①行填“向左”、“向右”或“不移动” 第②行填“增大”、“减小”或“不变”]

 CH3COO-+H+ ΔH>0。
CH3COO-+H+ ΔH>0。
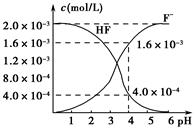

 能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。
能起到使人体血液pH保持在7.35~7.45的作用。①请用电解质溶液中的平衡解释: (用离子方程式表示)。 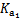 ≈ 。
≈ 。  不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确
不超过其总量的10%。请你设计简单实验证明该同学的观点是否正确  2Ca2++2K++Mg2++4SO42—+2H2O
2Ca2++2K++Mg2++4SO42—+2H2O