题目内容
【题目】Ⅰ. 依据事实,写出下列反应的热化学方程式。
(1)在25 ℃、101 kPa下,1 g液态甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧的热化学方程式为________________________________________________。
(2)用NA表示阿伏加德罗常数,在C2H2(气态)完全燃烧生成CO2和液态水的反应中,每有5NA个电子转移时,放出650 kJ的热量,则表示该反应的热化学方程式为_______________________。
Ⅱ.(1)下列事实能用化学平衡移动来原理解释的是 _________
A.打开冰啤酒瓶盖,看到瓶中啤酒冒出大量气泡
B.对反应2NO2(g)![]() N2O4(g), 压缩体积平衡体系颜色变深
N2O4(g), 压缩体积平衡体系颜色变深
C.对SO2催化氧化成SO3的反应,往往加入过量的空气提高SO2转化率
(3)在一定条件下,将H2和N2置于容积为2 L的密闭容器中发生N2(g) + 3H2(g) ![]() 2NH3(g)反应,若充入N2(g)为0.80 mol和H2(g)为1.60 mol,反应在一定条件下达到平衡时,NH3的体积分数为20%,计算出相同温度下反应2NH3(g)
2NH3(g)反应,若充入N2(g)为0.80 mol和H2(g)为1.60 mol,反应在一定条件下达到平衡时,NH3的体积分数为20%,计算出相同温度下反应2NH3(g)![]() N2(g) + 3H2(g)的平衡常数为____________;
N2(g) + 3H2(g)的平衡常数为____________;
【答案】 CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1 2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-2 600 kJ·mol-1 A、C 0.94
O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1 2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-2 600 kJ·mol-1 A、C 0.94
【解析】本题主要考查化学平衡的移动、判断及计算。
Ⅰ. (1)在25 ℃、101 kPa下,32 g即1mol液态甲醇燃烧生成CO2和液态水时放热725.76 kJ。则表示甲醇燃烧的热化学方程式为CH3OH(l)+![]() O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1。
O2(g)===CO2(g)+2H2O(l) ΔH=-725.76 kJ·mol-1。
(2)C2H2~10e-,每有5NA个电子转移时,放出650 kJ的热量,则表示该反应的热化学方程式为2C2H2(g)+5O2(g)===4CO2(g)+2H2O(l) ΔH=-2 600 kJ·mol-1。
Ⅱ.(1)下列事实能用化学平衡移动来原理解释的是 AC。
A.打开冰啤酒瓶盖,气压减小,二氧化碳的溶解平衡左移,二氧化碳的溶解度减小,瓶中啤酒冒出大量气泡,故A能用化学平衡移动来原理解释;B.对反应2NO2(g)![]() N2O4(g), 压缩体积,气体浓度增大,平衡体系颜色变深,故B不能用化学平衡移动来原理解释;C.对SO2催化氧化成SO3的反应,加入过量的空气,反应物氧气的浓度增大,平衡右移,提高SO2转化率,故C能用化学平衡移动来原理解释。故选AC。
N2O4(g), 压缩体积,气体浓度增大,平衡体系颜色变深,故B不能用化学平衡移动来原理解释;C.对SO2催化氧化成SO3的反应,加入过量的空气,反应物氧气的浓度增大,平衡右移,提高SO2转化率,故C能用化学平衡移动来原理解释。故选AC。
(3)平衡时,设消耗N2xmol,则(0.80+1.60-2x)20%=2x,x=0.2。c(N2)=0.3mol/L,c(H2)=0.5mol/L,c(NH3)=0.2mol/L,相同温度下反应2NH3(g)![]() N2(g) + 3H2(g)的平衡常数为
N2(g) + 3H2(g)的平衡常数为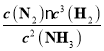 =0.94。
=0.94。

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案