题目内容
【题目】利用电导法测定某浓度醋酸电离的ΔH、Ka随温度变化曲线关系如图。已知整个电离过程包括氢键断裂、醋酸分子解离、离子水合。下列有关说法不正确的是
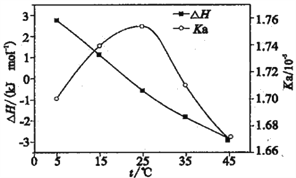
A. 理论上ΔH=0时,Ka最大
B. 25℃时,[CH3COOH]最大
C. 电离的热效应较小是因为分子解离吸收的能量与离子水合放出的能量相当
D. CH3COOH溶液中存在氢键是ΔH随温度升高而减小的主要原因
【答案】B
【解析】A、理论上△H=0时,电离程度最大,氢离子和醋酸根离子浓度最大,Ka最大,故A正确;B、25℃时,,Ka最大,电离程度最大,平衡时醋酸分子的浓度[CH3COOH]最小,故B错误;C、分子解离吸收的能量与离子水合放出的能量相当时,拆开化学键吸收的能量与水合时放出的热量相当,电离的热效应较小,故C正确;D、拆开氢键需要能量,但随温度的升高,氢键越来越小,CH3COOH溶液中存在氢键是△H随温度升高而减小的主要原因,故D正确;故选B。

练习册系列答案
相关题目
【题目】在不同温度下,向V L密闭容器中加入0.5 mol NO和0.5 mol活性炭,发生反应:
2NO(g)+C(s)![]() N2(g)+CO2(g) △H= —Q kJ·mol-1(Q>0),达到平衡时的数据如下:
N2(g)+CO2(g) △H= —Q kJ·mol-1(Q>0),达到平衡时的数据如下:
温度/℃ | n (C)/mol | n(CO2)/mol |
T1 | 0.15 | |
T2 | 0.375 |
下列有关说法正确的是
A. 由上述信息可推知:T1 > T2
B. T2℃时,若反应达平衡后再缩小容器的体积,c (N2):c (NO)增大
C. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率增大
D. T1℃时,该反应的平衡常数![]()



