题目内容
【题目】现有五种物质A、B、C、D、E,其中有一种是碱,四种是盐,溶于水后电离可以产生下表中的离子:
阳离子 | Na+ H+ Ba2+ |
阴离子 | OH- CO32- SO42- |
为鉴别它们,分别完成以下实验,其结果如下:
①A溶液与B溶液反应生成无色气体X,气体X可以与C溶液反应生成沉淀E,沉淀E可与B溶液反应;
②B溶液与C溶液反应生成白色沉淀D,沉淀D不溶于稀硝酸。
请根据上述实验结果,填空:
(1)写出物质的化学式:A______ X______。
(2) B溶于水后的电离方程式为______________________。
鉴别B中阴离子的实验操作方法是_____________________。
(3)写出 A溶液与B溶液反应的离子方程式:
________________________________________________________________________。
(4)D与E的混合物a g,加入足量盐酸,反应完毕生成标准状况下的气体b L,则D在混合物中的质量分数为________。(列出算式即可)
【答案】 A为Na2CO3 X、CO 2 NaHSO4=Na++H++SO42- 取少量生B的溶液于试管,先加入盐酸,再加入BaCl2溶液,生成白色沉淀,则溶液中含有SO42-; CO32-+2H+=CO2↑+H2O w(BaSO4)=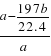 ×100%=1-
×100%=1-![]() ,故答案为:1-
,故答案为:1-![]() .
.
【解析】根据题意可知:生成的气体只有二氧化碳,反应2H++ CO32-= CO 2↑+ H2O,CO 2能够与C溶液反应生成沉淀E,则C为氢氧化钡,沉淀E为碳酸钡;沉淀E可与B溶液反应,B为硫酸氢钠;A溶液与B溶液反应生成无色气体X,X为二氧化碳,A为碳酸钠,B溶液与C溶液反应生成白色沉淀D,D为硫酸钡。
(1)由以上分析可知,A为Na2CO3,X为CO 2;正确答案:Na2CO3 ; CO 2。
(2) B为硫酸氢钠,溶于水后的电离方程式为NaHSO4=Na++H++SO42-,硫酸根离子检验方法:取少量B的溶液于试管,先加入盐酸,再加入BaCl2溶液,生成白色沉淀,则溶液中含有SO42-;正确答案:取少量B的溶液于试管,先加入盐酸,再加入BaCl2溶液,生成白色沉淀,则溶液中含有SO42-。
(3) A为碳酸钠,B为硫酸氢钠,碳酸钠溶液与硫酸氢钠反应生成二氧化碳、硫酸钠和水,反应的离子方程式CO32-+2H+=CO2↑+H2O;正确答案:CO32-+2H+=CO2↑+H2O。
(4) D为硫酸钡, E为碳酸钡,二者的混合物加入足量盐酸,硫酸钡不溶于盐酸,碳酸钡与盐酸反应,生成二氧化碳的体积b L,气体的量为b/22.4mol,则碳酸钡的量为b/22.4mol,质量为197 b/22.4 g,硫酸钡的质量为a-197 b/22.4 g,则硫酸钡的质量分数为w(BaSO4)=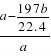 ×100%=1-
×100%=1-![]() ,正确答案:1-
,正确答案:1-![]() 。
。

【题目】已知在温度低于570 0C 时,还原铁粉与水蒸气反应的产物是FeO,高于570 0C时,生成Fe3O4。老师用上图所示实验装置,完成了还原铁粉与水蒸气反应的演示实验。
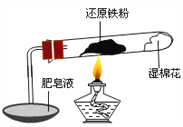
甲同学为探究实验后试管内的固体含有哪些物质,进行了下列实验:
实验编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末放入试管中,加入盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
② | 向试管中滴加几滴KSCN溶液,振荡 | 溶液没有出现血红色 |
根据上述实验,下列说法不正确的是( )
A. 试管内的固体一定含有铁粉
B. 试管内的固体一定不含有Fe3O4
C. 不能确定试管内的固体一定含有FeO
D. 可通过将试管内固体彻底还原,分析其质量减小的方法来确定是否含有Fe3O4
