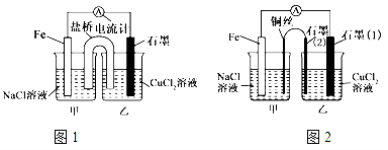
��Ŀ����
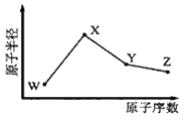
����Ŀ��X��Y��W��Z �����ֳ����Ķ�����Ԫ�أ���ԭ�Ӱ뾶��ԭ�������仯����ͼ��ʾ����֪ W ��һ�ֺ��ص�������Ϊ 18��������Ϊ 10��X��Neԭ�ӵĺ������������� 1��Y �ĵ�����һ�ֳ����İ뵼����ϣ� Z �ķǽ�������ͬ��������Ԫ������ǿ�� ����˵����ȷ���ǣ� ��
A. ����ϼۣ� X��Y��Z��W
B. ����̬�⻯����ȶ��ԣ� Z��Y��W
C. Y ���������� X�� Z ������������Ӧ��ˮ������ܷ�Ӧ
D. �� X�� Z�� W ����Ԫ���γɵĻ�����һ���Ⱥ������Ӽ��ֺ����ۼ�
���𰸡�D
�����������������W��������Ϊ18��������Ϊ10����������Ϊ(18��10)=8����WΪO��X��Neԭ�ӵĺ�����������Ϊ1����X������F��Ҳ������Na������ԭ�Ӱ뾶����XΪNa��Y������һ�ְ뵼����ϣ���YΪSi��ͬ�����д������ҷǽ�������ǿ����ZΪCl��A������ϼ۷ֱ���0����1����4����7�������ۻ��ϼ��ɴ�С��˳���ǣ�Cl>Si>Na>O���ʴ���B���ǽ�����Խǿ�����⻯���ȶ���Խǿ���ǽ�������ǿ������˳����O>Cl>Si���⻯���ȶ��ԣ�O>Cl>Si���ʴ���C��Y����������SiO2��X������������Ӧˮ������NaOH��Z������������Ӧˮ������HClO4��SiO2�������������NaOH��Ӧ��������HClO4��Ӧ���ʴ���D��NaClO��NaClO3���������ӻ�����������Ӽ����ۼ�������ȷ��

 ��ĩ���䵥Ԫ�����ิϰ��ϵ�д�
��ĩ���䵥Ԫ�����ิϰ��ϵ�д�����Ŀ���±���A��B�����л�����й���Ϣ��
A | B |
������ģ��Ϊ�� ����ʹ������Ȼ�̼��Һ��ɫ�� ��������Ǻ���ʯ�ͻ���ˮƽ�ı�־�� | ����C��H��O����Ԫ����ɣ��dz����еij�����ζ���� ��ˮ��Һ��ʹ��ɫʯ����Һ��졣 |
���ݱ�����Ϣ�ش��������⣺
(1)����A������˵���У�����ȷ����__________(����)��
a�������ﺬ��̼̼˫�� b�����������е�ԭ�ӹ�ƽ�� c���ṹ��ʽΪCH2-CH2
(2)A��H2�����ӳɷ�Ӧ������X����X�ڷ�����ɺͽṹ�����Ƶ��л�����һ���࣬���ǵ�ͨʽΪCnH2n+2����n=_________ʱ�������ǻ��↑ʼ����ͬ���칹�ݡ�
(3)B���Ҵ���Ӧ�Ļ�ѧ����ʽΪ_____________����Ӧ����Ϊ_______________��
(4)��AΪԭ�Ͽ�ֱ������һ�ָ߷��ӻ�����P����P�Ľṹ��ʽΪ_______________��