题目内容
【题目】下列离子方程式中正确的是( )
A.用石墨作电极电解饱和NaCl溶液:2Cl﹣+2H2O ![]() Cl2↑+H2↑+2OH﹣
Cl2↑+H2↑+2OH﹣
B.向明矾溶液中逐滴加入Ba(OH)2溶液至Al3+刚好沉淀完全:
Al3++SO42﹣+Ba2++3OH﹣═BaSO4↓+Al(OH)3↓
C.过量氯气通入溴化亚铁溶液中:2Cl2+2Fe2++2Br﹣═4Cl﹣+2Fe3++Br2
D.向氯化铝溶液通入过量的氨气:Al3++4OH﹣═AlO2﹣+2H2O
【答案】A
【解析】A、用石墨作电极电解饱和NaCl溶液:2Cl﹣+2H2O ![]() Cl2↑+H2↑+2OH﹣,A符合题意;
Cl2↑+H2↑+2OH﹣,A符合题意;
B、向明矾溶液中逐滴加入Ba(OH)2溶液至Al3+刚好沉淀完全,明矾和氢氧化钡按照2:3反应,2Al3++3SO42﹣+3Ba2++6OH﹣═3BaSO4↓+2Al(OH)3↓,B不符合题意;
C、过量氯气通入溴化亚铁溶液中,溴离子和亚铁离子全部被氧化,离子方程式中溴化亚铁符合分子式的组成比;2Cl2+2Fe2++4Br﹣═4Cl﹣+2Fe3++2Br2,C不符合题意;
D、向氯化铝溶液通入过量的氨气:Al3++3NH3H2O═Al(OH)3↓+3H+,D不符合题意;
所以答案是:A.

练习册系列答案
相关题目
【题目】下图是用点滴板探究氨气的性质。实验时向NaOH固体上滴几滴浓氨水后,立即用培养皿罩住整个点滴板。下列对实验现象的解释正确的是( )
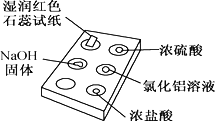
选项 | 实验现象 | 解释 |
A | 红色石蕊试纸变蓝 | NH3极易溶于水 |
B | 浓硫酸附近无白烟 | NH3与浓硫酸不发生反应 |
C | 氯化铝溶液变浑浊 | NH3与AlCl3溶液反应:Al3++3OH-=Al(OH)3↓ |
D | 浓盐酸附近有白烟 | NH3与挥发出的HCl反应:NH3+HCl=NH4Cl |
A. A B. B C. C D. D