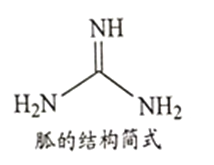
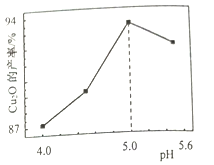
题目内容
【题目】NH4Al(SO4)2·12H2O (铵明矾) 可用作泡沫灭火器的内留剂、石油脱色剂等。用氧化铁和铝粉等物质做铝热反应后的铝灰及硫酸铵等为原料制备铵明矾的实验步骤如下:
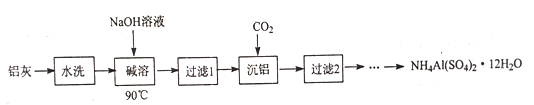
(1) 铝灰用“水洗”的目的是______碱溶时,需在约90℃条件下进行,适宜的加热方式为_____。
(2)“过滤1”所得滤渣主要成分为_________。
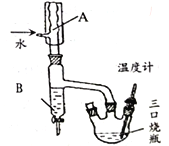
(3)用下图左边装置制备CO2时,适宜的药品A 为________、B 为__________;“沉铝”时,通入过量CO2 发生反应的离子方程式为________。
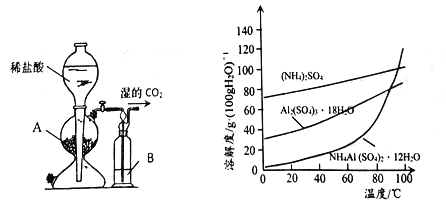
(4)请设计从“过滤2”所得滤渣制取铵明矾的实验方案: 称取一定质量“过滤2”的滤渣,放入烧杯中,____,静置,过滤、洗涤、晾干,得到NH4Al(SO4)2·12H2O [实验中须使用到3mol/L硫酸、(NH4)2SO4、蒸馏水、氨水、pH 试纸; 已知: NH4Al(SO4)2饱和溶液的pH约为1.5,几种物质的溶解度曲线见右上图]。
【答案】 除去KCl等可溶性杂质 水浴加热 Fe等 饱和NaHCO3溶液 块状石灰石(或大理石、CaCO3等) AlO2- +CO2+2H2O= Al(OH)3↓+HCO3- 加入适量蒸馏水,加热并在不断搅拌下加入3mol/L硫酸至沉淀恰好完全溶解,再加入计算量的(NH4)2SO4,用3mol/L硫酸和氨水调节溶液的PH 在1~2之间,蒸发浓縮,冷却结品
【解析】铝灰水洗的目的是洗去表面可溶性杂质,在90℃水浴条件下,用NaOH溶液进行溶解,Al2O3+2OH-=2AlO2-+H2O,过滤除去铁等不溶性杂质,向滤液中通入CO2, AlO2- +CO2+2H2O= Al(OH)3↓+HCO3- ,提纯得到较纯的Al(OH)3再制备NH4Al(SO4)2。
(1) 铝灰用“水洗”的目的是除去KCl等可溶性杂质,碱溶时,需在约90℃条件下进行,适宜的加热方式为90℃水浴加热;(2)“过滤1”所得滤渣主要成分为铁等不溶杂质;(3)制备CO2时,适宜的药品A 为块状石灰石(或大理石、CaCO3等) 、B 为饱和NaHCO3溶液除去挥发出来的HCl;“沉铝”时,通入过量CO2 发生反应的离子方程式为AlO2- +CO2+2H2O= Al(OH)3↓+HCO3- ;(4) 称取一定质量“过滤2”的滤渣,主要成分为Al(OH)3放入烧杯中,加入适量蒸馏水,加热并在不断搅拌下加入3mol/L硫酸至沉淀恰好完全溶解,再加入计算量的(NH4)2SO4,用3mol/L硫酸和氨水调节溶液的PH 在1~2之间,蒸发浓縮,冷却结品,静置,过滤、洗涤、晾干,得到NH4Al(SO4)2·12H2O。

【题目】碳及其化合物在工农业上有重要作用。
Ⅰ、在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g) ![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表所示:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如表所示:
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___________。该反应为__________(填“吸热”或“放热”)反应。
(2)某温度下平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),该温度下加入1 mol CO2(g)和1 mol H2(g),充分反应,达到平衡时,CO2的转化率为______________。
(3)在800 ℃时发生上述反应,某时刻测得容器内各物质的浓度分别为c(CO2)为2 mol/L,c(H2)为1.5 mol/L,c(CO)为1 mol/L,c(H2O)为3 mol/L,则正、逆反应速率的比较为:v正___________v逆(填“>”“<”或“=”)。
Ⅱ、工业上用CO2和H2反应合成甲醚。已知:
CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=-53.7kJmol-1
CH3OCH3(g)+H2O(g)═2CH3OH(g)△H2=+23.4kJmol-1
则2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)△H3=_______________kJ·mol-1。
CH3OCH3(g)+3H2O(g)△H3=_______________kJ·mol-1。
Ⅲ、常温下用氨水吸收CO2可得到NH4HCO3溶液,在该溶液中,c(NH4+)________(填“>”、“<”或“=”)c(HCO3—);反应NH4++HCO3—+H2O![]() NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2
NH3·H2O+H2CO3的平衡常数K=__________。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2