题目内容
1g H2燃烧生成液态水放出142.9kJ的热量,下列热化学方程式正确的是
A.2H2(g)+ O 2(g) = 2H2O(1)
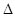 H = —142.9kJ·molˉl
H = —142.9kJ·molˉl
B.2H2(g)+ O 2(g) = 2H2O(1)
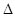 H = —571.6kJ·molˉl
H = —571.6kJ·molˉl
C.2H2+O2 = 2H2O
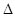 H = —571.6lkJ·molˉl
H = —571.6lkJ·molˉl
D.H2(g)+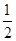 O 2(g) = H2O(1)
O 2(g) = H2O(1) 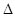 H = +285.8kJ·molˉl
H = +285.8kJ·molˉl
【答案】
B
【解析】

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目

 或
或 

 水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为________________ ________________。
水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为________________ ________________。