题目内容
(2010?长春一模)下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:

(1)④⑤⑥的原子半径由小到大的顺序为(用元素符号表示)
②③⑦的最高价含氧酸的酸性由弱到强的顺序是(用化学式表示)
(2)写出由以上某些元素构成的既含离子键、又含极性共价键的化合物的电子式(写出一种即可) 或
或 
 或
或  .
.
(3)已知常温下1g ①单质在④单质中燃烧生成稳定的液态物质时放出142.9kJ热量,则表示①单质燃烧热的热化学方程式为
(4)①②形成的最简单的化合物与④单质在KOH作电解液时可形成原电池,其中负极的电极反应为
(5)由表中元素①③④⑥⑧所形成的常见物质X、Y、Z、M、N可发生以下反应:

①X溶液与Y溶液反应的离子方程式为
②N→⑥的单质所采用的方法是
③M溶液呈酸性,原因是(用离子方程式解释)

(1)④⑤⑥的原子半径由小到大的顺序为(用元素符号表示)
O<Al<Na
O<Al<Na
.②③⑦的最高价含氧酸的酸性由弱到强的顺序是(用化学式表示)
H2SiO3<H2CO3<HNO3
H2SiO3<H2CO3<HNO3
.(2)写出由以上某些元素构成的既含离子键、又含极性共价键的化合物的电子式(写出一种即可)
 或
或 
 或
或 
(3)已知常温下1g ①单质在④单质中燃烧生成稳定的液态物质时放出142.9kJ热量,则表示①单质燃烧热的热化学方程式为
H2(g)+
O2(g)═H2O(l)△H=-285.8kJ/mol
| 1 |
| 2 |
H2(g)+
O2(g)═H2O(l)△H=-285.8kJ/mol
.| 1 |
| 2 |
(4)①②形成的最简单的化合物与④单质在KOH作电解液时可形成原电池,其中负极的电极反应为
CH4+10OH--8e-═CO32-+7H2O
CH4+10OH--8e-═CO32-+7H2O
.(5)由表中元素①③④⑥⑧所形成的常见物质X、Y、Z、M、N可发生以下反应:

①X溶液与Y溶液反应的离子方程式为
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
Al3++3NH3?H2O=Al(OH)3↓+3NH4+
;②N→⑥的单质所采用的方法是
电解法
电解法
;③M溶液呈酸性,原因是(用离子方程式解释)
NH4++H2O?NH3?H2O+H+
NH4++H2O?NH3?H2O+H+
.分析:根据元素所在周期表中的位置,可知元素的种类,①为H元素,②为C元素,③为N元素,④为O元素,⑤为Na元素,⑥为Al元素,⑦为Si元素,⑧为Cl元素,
(1)周期表中,同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大;
元素的非金属性越强,对应的最高价含氧酸的酸性越强;
(2)①、④、⑤、⑧中的某些元素可形成NaOH、NaClO等离子化合物;
(3)1g氢气燃烧放出热量为142.9kJ,则1molH2燃烧放出的热量为142.9kJ×2,以此来分析;
(4)①②形成的最简单的化合物为CH4,与氧气、KOH溶液构成燃料电池,在负极上甲烷失去电子被氧化;
(5)⑥为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应;根据盐类水解的知识来判断溶液的酸碱性.
(1)周期表中,同周期元素从左到右原子半径逐渐减小,同主族元素从上到下原子半径逐渐增大;
元素的非金属性越强,对应的最高价含氧酸的酸性越强;
(2)①、④、⑤、⑧中的某些元素可形成NaOH、NaClO等离子化合物;
(3)1g氢气燃烧放出热量为142.9kJ,则1molH2燃烧放出的热量为142.9kJ×2,以此来分析;
(4)①②形成的最简单的化合物为CH4,与氧气、KOH溶液构成燃料电池,在负极上甲烷失去电子被氧化;
(5)⑥为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应;根据盐类水解的知识来判断溶液的酸碱性.
解答:解:根据元素所在周期表中的位置,可知元素的种类,①为H元素,②为C元素,③为N元素,④为O元素,⑤为Na元素,⑥为Al元素,⑦为Si元素,⑧为Cl元素,
(1)Na与Al同周期,周期表中,同周期元素从左到右原子半径逐渐减小,则原子半径Na>Al,原子核外电子层数越多,半径越大,则有原子半径为O<Al<Na,又②、③、⑦对应的元素分别为C、N、Si,非金属性:N>C>Si,元素的非金属性越强,对应的最高价含氧酸的酸性越强,则酸性为H2SiO3<H2CO3<HNO3,
故答案为:O<Al<Na;H2SiO3<H2CO3<HNO3;
(2)①、④、⑤、⑧中的某些元素可形成NaOH、NaClO等离子化合物,同时含有极性共价键,它们的电子式分别为 、
、 ,
,
故答案为: 或
或  ;
;
(3)1g氢气燃烧放出热量为142.9kJ,则1molH2燃烧放出的热量为142.9kJ×2=285.8kJ/mol,则燃烧热的热化学反应方程式为H2(g)+
O2(g)═H2O(l)△H=-285.8kJ/mol,
故答案为:H2(g)+
O2(g)═H2O(l)△H=-285.8kJ/mol;
(4)①②形成的最简单的化合物为CH4,与氧气、KOH溶液构成燃料电池,在负极上甲烷失去电子被氧化,
则负极反应为CH4+10OH--8e-═CO32-+7H2O,
故答案为:CH4+10OH--8e-═CO32-+7H2O;
(5)①由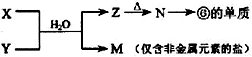 反应转化可知,⑥为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应,X溶液与Y溶液反应的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+;故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
反应转化可知,⑥为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应,X溶液与Y溶液反应的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+;故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
②工业冶炼铝用电解氧化铝的方法,反应方程式为2Al2O3(熔融)
4Al+3O2↑,故答案为:电解法;
②M溶液中铵根离子水解呈酸性,水解离子反应为NH4++H2O?NH3?H2O+H+,故答案为:NH4++H2O?NH3?H2O+H+.
(1)Na与Al同周期,周期表中,同周期元素从左到右原子半径逐渐减小,则原子半径Na>Al,原子核外电子层数越多,半径越大,则有原子半径为O<Al<Na,又②、③、⑦对应的元素分别为C、N、Si,非金属性:N>C>Si,元素的非金属性越强,对应的最高价含氧酸的酸性越强,则酸性为H2SiO3<H2CO3<HNO3,
故答案为:O<Al<Na;H2SiO3<H2CO3<HNO3;
(2)①、④、⑤、⑧中的某些元素可形成NaOH、NaClO等离子化合物,同时含有极性共价键,它们的电子式分别为
 、
、 ,
,故答案为:
 或
或  ;
;(3)1g氢气燃烧放出热量为142.9kJ,则1molH2燃烧放出的热量为142.9kJ×2=285.8kJ/mol,则燃烧热的热化学反应方程式为H2(g)+
| 1 |
| 2 |
故答案为:H2(g)+
| 1 |
| 2 |
(4)①②形成的最简单的化合物为CH4,与氧气、KOH溶液构成燃料电池,在负极上甲烷失去电子被氧化,
则负极反应为CH4+10OH--8e-═CO32-+7H2O,
故答案为:CH4+10OH--8e-═CO32-+7H2O;
(5)①由
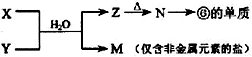 反应转化可知,⑥为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应,X溶液与Y溶液反应的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+;故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
反应转化可知,⑥为Al元素,则N为Al2O3,Z为Al(OH)3,M为仅含非金属元素的盐,应为铵盐,则反应X+Y应是氨气和铝盐在水溶液中的反应,X溶液与Y溶液反应的离子方程式为Al3++3NH3?H2O=Al(OH)3↓+3NH4+;故答案为:Al3++3NH3?H2O=Al(OH)3↓+3NH4+;②工业冶炼铝用电解氧化铝的方法,反应方程式为2Al2O3(熔融)
| ||
②M溶液中铵根离子水解呈酸性,水解离子反应为NH4++H2O?NH3?H2O+H+,故答案为:NH4++H2O?NH3?H2O+H+.
点评:本题考查元素的推断,题目难度不大,根据元素在周期表中的物质可推断出元素的种类是解答本题的关键,并注意了知识的综合考查、热点考查、基础知识的考查,为较好的习题.

练习册系列答案
相关题目
 (2010?长春一模)向一定量的K2CO3溶液中缓慢滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中各离子数目也相应地发生变化.溶液中各离子数目与图中四条曲线的对应关系完全正确的是( )
(2010?长春一模)向一定量的K2CO3溶液中缓慢滴加稀盐酸,并不断搅拌.随着盐酸的加入,溶液中各离子数目也相应地发生变化.溶液中各离子数目与图中四条曲线的对应关系完全正确的是( )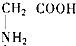 中,跟盐酸和氢氧化钠溶液都能反应的是( )
中,跟盐酸和氢氧化钠溶液都能反应的是( )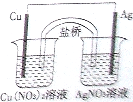 (2010?长春一模)用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是
(2010?长春一模)用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)构成一个原电池(如图).以下有关该原电池的叙述正确的是