题目内容
【题目】随着科学技术的发展和环保要求的不断提高,CO2的捕集利用技术成为研究的重点。完成下列填空:
(1)目前国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:
CO2(g)+4H2(g) ![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
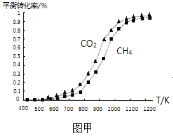
已知H2的体积分数随温度升高而增加。
若温度从300℃升至400℃,重新达到平衡,判断下列表格中各物理量的变化。(选填“增大”、“减小”或“不变”)
v正 | v逆 | 平衡常数K | 转化率α(H2) |
(2)相同温度,上述反应在不同起始浓度下分别达到平衡,各物质的平衡浓度如下表:
[CO2]/mol·L-1 | [H2]/mol·L-1 | [CH4]/mol·L-1 | [H2O]/mol·L-1 | |
平衡Ⅰ | a | b | c | d |
平衡Ⅱ | m | n | x | y |
a、b、c、d与m、n、x、y之间的关系式为_________。(用含有a、b、c、d、m、n、x、y的一个代数式表示)
(3)碳酸H2CO3,K1=4.3×10-7,K2=5.6×10-11,草酸H2C2O4,K1=5.9×10-2,K2=6.4×10-50.1 mol/L Na2CO3溶液的pH____________0.1 mol/L Na2C2O4溶液的pH。(选填“大于”、“小于”或“等于”)等浓度的草酸溶液和碳酸溶液中,氢离子浓度较大的是___________。
若将等浓度的草酸溶液和碳酸溶液等体积混合,溶液中各种离子浓度大小的顺序正确的是_____________。(选填编号)
A.[H+]>[HC2O4-]>[HCO3-]>[CO32-]
B.[HCO3-]>[HC2O4-]>[C2O42-]>[CO32-]
C.[H+]>[HC2O4-]>[C2O42-]>[CO32-]
D.[H2CO3] >[HCO3-]>[HC2O4-]>[CO32-]
(4)人体血液中的碳酸和碳酸氢盐存在平衡:H++ HCO3-![]() H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。___________________________
H2CO3,当有少量酸性或碱性物质进入血液中时,血液的pH变化不大,用平衡移动原理解释上述现象。___________________________
【答案】(1)
v正 | v逆 | 平衡常数K | 转化率α |
增大 | 增大 | 减小 | 减小 |
(2)![]() (3)大于 AC (4)当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变
(3)大于 AC (4)当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变
【解析】
试题分析:(1)H2的体积分数随温度的升高而增加,这说明升高温度平衡逆反应方向进行,即正反应是放热反应.升高温度正、逆反应速率均增大,平衡逆反应方向进行,平衡常数减小,反应物的转化率减小;
(2)相同温度时平衡常数不变,则a、b、c、d与m、n、x、y之间的关系式为![]() ;
;
(3)根据电离常数可知草酸的酸性强于碳酸,则碳酸钠的水解程度大于草酸钠,所以0.1 mol/L Na2CO3溶液的pH大于0.1 mol/L Na2C2O4溶液的pH,草酸的酸性强于碳酸,则等浓度草酸溶液和碳酸溶液中,氢离子浓度较大的是草酸,草酸的二级电离常数均大于碳酸的,所以草酸的电离程度大于碳酸,且碳酸以第一步电离为主,因此溶液中c(H+)>c(HC2O4-)>c(C2O42-)>c(HCO3-)>c(CO32-),则ac正确,bd错误;故答案为AC;
(4)根据平衡可知当少量酸性物质进入血液中,平衡向右移动,使H+浓度变化较小,血液中的pH基本不变;当少量碱性物质进入血液中,平衡向左移动,使H+浓度变化较小,血液的pH基本不变。