题目内容
【题目】某大学研制了一种新型的乙醇电池,电池总反应为C2H5OH+3O2=2CO2+3H2O,电池示意如图,下列说法不正确的是( )
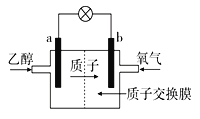
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为4H++O2+4e-=2H2O
D.电池工作时,1mol乙醇被氧化时就有6mol电子转移
【答案】D
【解析】
A、由总反应可知,乙醇被氧化,故a电极为电池的负极,故A不符合题意;
B、a电极上乙醇失去电子,电子通过导线流向b电极,故电流由b极沿导线经灯泡再到a极,故B不符合题意;
C、该电解质溶液为酸性,正极为氧气发生还原反应,其电极反应式为:4H++O2+4e-=2H2O,故C不符合题意;
D、电池工作过程中,乙醇中碳元素从-2价升高至+4价,1mol乙醇被氧化时就有1mol×[4-(-2)]×2=12mol电子转移,故D符合题意;
故答案为D。

练习册系列答案
相关题目