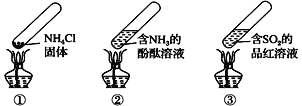
题目内容
【题目】室温下,若溶液中由水电离产生的c(H+)=1×10-12 mol/L,满足此条件的溶液中一定可以大量共存的离子组是( )
A.Al3+、Na+、NO3-、Cl-B.K+、Na+、Cl-、NO3-
C.K+、Na+、HCO3-、NO3-D.K+、NH4+、SO42-、NO3-
【答案】B
【解析】
室温下,若溶液中由水电离产生的c(H+)=1×10-12 mol/L,说明水的电离受到抑制,溶液可能为酸溶液,也可能为碱溶液,以此判断微粒是否一定能够大量共存。
A、若溶液为碱溶液,溶液中Al3+与OH-会发生反应,不能大量共存,故A不符合题意;
B、无论溶液为酸性或者碱性,K+、Na+、Cl-、![]() 均不会与其发生反应,能够大量共存,故B符合题意;
均不会与其发生反应,能够大量共存,故B符合题意;
C、无论溶液为酸性或者碱性,![]() 会与H+以及OH-发生反应而不能大量共存,故C不符合题意;
会与H+以及OH-发生反应而不能大量共存,故C不符合题意;
D、若溶液为碱溶液,溶液中![]() 与OH-会发生反应生成弱电解质NH3·H2O,故D不符合题意;
与OH-会发生反应生成弱电解质NH3·H2O,故D不符合题意;
故答案为B。

【题目】现使用酸碱中和滴定法测定市售白醋的浓度。
Ⅰ.实验步骤:
(1)用酸式滴定管取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴_____作指示剂。
(2)读取盛装0.1000 mol/L NaOH溶液的碱式滴定管的初始读数。如果液面位置如图所示,则此时的读数为________mL。
![]()
(3)滴定。当__________时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
1 | 2 | 3 | 4 | |
V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(1)数据处理可得c(市售白醋)=_____mol/L。
(2)在本实验的滴定过程中,下列操作会使实验结果偏大的是_____(填写字母)。
A.碱式滴定管在滴定时未用标准NaOH溶液润洗
B.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
C.锥形瓶中加入待测白醋溶液后,再加少量水
D.滴定终点读数时俯视读数