题目内容
(7分) A、B、C、D是四种短周期元素,E、F是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为: ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E、F的外围电子排布式分别为3d54s1,3d64s2,回答下列问题:
,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E、F的外围电子排布式分别为3d54s1,3d64s2,回答下列问题:
(1)、A的基态原子的电子排布式是 ;
(2)、B的最高价氧化物的化学式为 ,C的最低负化合价为 。
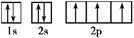
(3)、用轨道表示式表示D原子核外电子排布
;
(4)、解释为什么E的外围电子排布式为3d`54s1,而不为3d 44s2 ?
;
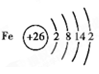
(5)、F原子结构示意图是 。
 ,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E、F的外围电子排布式分别为3d54s1,3d64s2,回答下列问题:
,B是同周期除稀有气体外半径最大的元素,C的最外层有三个成单电子,E、F的外围电子排布式分别为3d54s1,3d64s2,回答下列问题:(1)、A的基态原子的电子排布式是 ;
(2)、B的最高价氧化物的化学式为 ,C的最低负化合价为 。
(3)、用轨道表示式表示D原子核外电子排布
;
(4)、解释为什么E的外围电子排布式为3d`54s1,而不为3d 44s2 ?
;
(5)、F原子结构示意图是 。
(1)、1s22s22p63s23p2(1分);(2)、Na2O、-3(各1分),
(3) (1分)
(1分)
(4) E的外围电子呈3d`54s1时,3d、4s轨道上的电子处于半满状态, 整个体系的能量最低。(2分)
(5) (1分)
(1分)
(3)
 (1分)
(1分) (4) E的外围电子呈3d`54s1时,3d、4s轨道上的电子处于半满状态, 整个体系的能量最低。(2分)
(5)
 (1分)
(1分)根据A原子的结构示意图可知,A是硅,所以B是钠,C是P,D是N。E、F的外围电子排布式分别为3d54s1,3d64s2,所以E是铬,F是铁。
(1)根据构造原理可知,硅原子的的基态原子的电子排布式是1s22s22p63s23p2。
(2)钠的最高价是+1价,所以最高价氧化物是Na2O。P是第ⅤA元素,所以最低价是-3价。
(3)根据构造原理可知,氮原子的轨道表达式为 。
。
(4)由于轨道中的电子处于全充满或半充满是最稳定的,体系的能量才是最低的,所以铬原子的的外围电子排布式为3d`54s1,而不为3d 44s2 。
(5)原子结构示意图是表示原子核电荷数和电子层排布的图示形式。小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数。所以铁原子的结构示意图为 。
。
(1)根据构造原理可知,硅原子的的基态原子的电子排布式是1s22s22p63s23p2。
(2)钠的最高价是+1价,所以最高价氧化物是Na2O。P是第ⅤA元素,所以最低价是-3价。
(3)根据构造原理可知,氮原子的轨道表达式为
 。
。(4)由于轨道中的电子处于全充满或半充满是最稳定的,体系的能量才是最低的,所以铬原子的的外围电子排布式为3d`54s1,而不为3d 44s2 。
(5)原子结构示意图是表示原子核电荷数和电子层排布的图示形式。小圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上的数字表示该层的电子数。所以铁原子的结构示意图为
 。
。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目