题目内容
【题目】完成下列有关KMnO4溶液和H2C2O4溶液的实验:
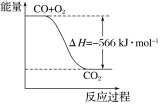
【实验一】用0.01mol/L 酸性KmnO4溶液和0.2mol/L H2C2O4溶液分别进行了如图所示的三组实验,用于探究不同条件对化学反应速率的影响。回答下列问题:
(1)KMnO4溶液需用_____进行酸化,参加反应的物质n(KMnO4):n(H2C2O4)=_____.

(2)第一组实验中褪色时间更长的是:_____(填“A”或“B”)组实验。
(3)第二组实验中B组实验中X为:__________。

(4)第三组实验发现Mn2+能加快该反应的速率,催化剂Y的化学式为_________。
【实验二】测定某乙二酸晶体(H2C2O4·xH2O)中的x值,具体操作如下:
(5)滴定:称取2.52g 乙二酸晶体,配成100mL溶液,准确量取25.00mL乙二酸溶液于锥形瓶中,加少量酸酸化,将0.1mol/L KMnO4标准溶液装入_____(填“酸式”或“碱式”)滴定管,进行滴定操作。在实验中发现,刚滴下少量KMnO4溶液时,需将锥形瓶摇动一段时间后,紫红色才慢慢褪去,再继续滴加时,紫红色就很快褪去了。出现上述现象的原因是_______。待到______,证明达到滴定终点。
(6)计算:再重复上述操作3次,记录数据如下表:
实验次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 0.00 | 20.10 |
2 | 1.00 | 20.90 |
3 | 0.20 | 20.20 |
4 | 0.00 | 22.10 |
则x为__________。
(7)误差分析:下列操作会导致测量的乙二酸溶液浓度偏高的是_______(填序号)
A.配制KMnO4标准溶液定容时,仰视观察刻度线
B.不小心将少量酸性KMnO4标准溶液滴到锥形瓶外
C.滴定前锥形瓶中有少量蒸馏水
D.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
E.观察读数时,滴定前仰视读数,滴定后俯视读数
【答案】 稀硫酸(或稀H2SO4) 2:5 A 1mL蒸馏水(或1mL H2O) MnSO4 酸式 反应中生成的Mn2+具有催化作用,能使褪色加快 滴入最后一滴KMnO4溶液,锥形瓶内的颜色恰好变成(浅)紫红色,且半分钟不变化 2 ABD
【解析】本题分析:本题主要考查氧化还原反应。
(1)在常见酸中,为了避免硝酸的强氧化性和氯化氢的还原性影响KMnO4的氧化性,KMnO4溶液需用稀硫酸进行酸化,参加反应的物质KMnO4→MnSO4,Mn的化合价+7→+2,降低5,H2C2O4→2CO2,C的化合价+3→+4,升高1,化合价升降总值相等,所以n(KMnO4):n(H2C2O4)=2:5.
(2)第一组实验中褪色时间更长的是使用冷水的A组实验。
(3)要保持草酸溶液的体积均为2mL,第二组实验中B组实验中X为1mL水。
(4)第三组实验发现Mn2+能加快该反应的速率,催化剂Y的化学式为MnSO4。
(5)为了防止KMnO4溶液氧化腐蚀橡胶,将0.1mol/L KMnO4标准溶液装入酸式滴定管,进行滴定操作。
出现上述现象的原因是反应中生成的Mn2+具有催化作用,能使褪色加快。
待到滴入最后一滴KMnO4溶液,锥形瓶内的颜色恰好变成浅紫红色,且半分钟不变化,证明达到滴定终点。
(6)n(H2C2O4·xH2O)= ![]() =
=![]() =
=![]() mol,舍弃与其它数据不平行的第4组实验数据,消耗0.1mol/L KMnO4标准溶液体积的平均值为20.00mL,由2KMnO4~5H2C2O4可得5×0.1mol/L×20.00mL=2×
mol,舍弃与其它数据不平行的第4组实验数据,消耗0.1mol/L KMnO4标准溶液体积的平均值为20.00mL,由2KMnO4~5H2C2O4可得5×0.1mol/L×20.00mL=2×![]() mol×
mol×![]() ,解得x=2,则x为2。
,解得x=2,则x为2。
(7)A.配制的KMnO4标准溶液体积变大,浓度变小,使得消耗的KMnO4标准溶液体积变大,导致测量的乙二酸溶液浓度偏高;B.使得消耗的KMnO4标准溶液体积变大,导致测量的乙二酸溶液浓度偏高;C.不影响测量的乙二酸溶液浓度;D.使得消耗的KMnO4标准溶液体积变大,导致测量的乙二酸溶液浓度偏高;E.消耗的KMnO4标准溶液体积=终读数-初读数,初读数变大,终读数变小,使得消耗的KMnO4标准溶液体积数据变小,导致测量的乙二酸溶液浓度偏低。故选ABD。