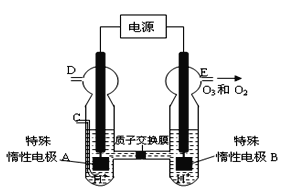
题目内容
【题目】常温下氨能被Cl2、Br2、H2O2等氧化,已知以下反应:8NH3+3Cl2→6NH4Cl+N2
已知该反应中,氨气不足时,也会有HCl产生。
(1)用单线桥标出电子转移的方向和数目。________
(2)这一反应中,氧化剂是________,氧化产物是________。
(3)若有3 mol N2生成,则发生氧化反应的物质有________mol。
(4)根据上述反应,若将浓氨水与Cl2靠近,将会看到______________________(现象)。
(5)当0.5LNH3与0.3LCl2充分反应后,气体的体积变为________L,若收集一瓶该产物气体,并使用该气体进行喷泉实验,并用紫色石蕊溶液作指示剂,最终溶液呈________色。
【答案】 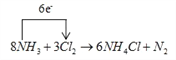 Cl2 N2 6 白烟 0.4 红
Cl2 N2 6 白烟 0.4 红
【解析】试题分析:本题通过NH3的性质研究,考查电子转移的表示方法、氧化剂和氧化产物的判断、实验现象、氧化还原反应的简单计算。
解析:(1)反应转移电子数目为6,正确答案:![]() 。(2)反应中的Cl元素从0价减低到-1价,氧化剂是Cl2,N元素从-3价升高到0价,氧化产物是N2。正确答案:Cl2、N2。(3)方程式研究发现,当有8molNH3发生反应时,被氧化生成的N2只有1mol,所以被氧化的NH3为2mol,所以3molN2生成时,发生氧化反应被氧化的NH3有6mol。正确答案:6mol。(4)由以上反应原理可知,浓氨水与Cl2靠近时,浓氨水挥发出的NH3能够与Cl2反应生成NH4Cl固体,所以会有白烟产生。正确答案:白烟。(5)NH3可以与Cl2反应:2NH3+3Cl2=N2+6HCl及8NH3+3Cl2=6NH4Cl+N2,所以当NH3与Cl2物质的量之比为0.5:0.3=5:3时,上述两个反应同时发生,设参加前一个反应的NH3为x L ,反应消耗Cl21.5x L,生成N2 0.5x L、HCl 3x L。则后一个反应消耗NH3为0.5-x L,反应消耗Cl2 3(0.5-x)/8 L,生成N2 (0.5-x)/8 L,则反应总消耗Cl2 1.5x+3(0.5-x)/8=0.3 ,x=0.1 ,剩余气体为N2和HCl,共 0.5x+3x+(0.5-x)/8=0.4L 。反应后的气体为N2和HCl,所以遇紫色石蕊试液变红。正确答案:0.4 、红。
。(2)反应中的Cl元素从0价减低到-1价,氧化剂是Cl2,N元素从-3价升高到0价,氧化产物是N2。正确答案:Cl2、N2。(3)方程式研究发现,当有8molNH3发生反应时,被氧化生成的N2只有1mol,所以被氧化的NH3为2mol,所以3molN2生成时,发生氧化反应被氧化的NH3有6mol。正确答案:6mol。(4)由以上反应原理可知,浓氨水与Cl2靠近时,浓氨水挥发出的NH3能够与Cl2反应生成NH4Cl固体,所以会有白烟产生。正确答案:白烟。(5)NH3可以与Cl2反应:2NH3+3Cl2=N2+6HCl及8NH3+3Cl2=6NH4Cl+N2,所以当NH3与Cl2物质的量之比为0.5:0.3=5:3时,上述两个反应同时发生,设参加前一个反应的NH3为x L ,反应消耗Cl21.5x L,生成N2 0.5x L、HCl 3x L。则后一个反应消耗NH3为0.5-x L,反应消耗Cl2 3(0.5-x)/8 L,生成N2 (0.5-x)/8 L,则反应总消耗Cl2 1.5x+3(0.5-x)/8=0.3 ,x=0.1 ,剩余气体为N2和HCl,共 0.5x+3x+(0.5-x)/8=0.4L 。反应后的气体为N2和HCl,所以遇紫色石蕊试液变红。正确答案:0.4 、红。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】完成下列有关KMnO4溶液和H2C2O4溶液的实验:
【实验一】用0.01mol/L 酸性KmnO4溶液和0.2mol/L H2C2O4溶液分别进行了如图所示的三组实验,用于探究不同条件对化学反应速率的影响。回答下列问题:
(1)KMnO4溶液需用_____进行酸化,参加反应的物质n(KMnO4):n(H2C2O4)=_____.

(2)第一组实验中褪色时间更长的是:_____(填“A”或“B”)组实验。
(3)第二组实验中B组实验中X为:__________。

(4)第三组实验发现Mn2+能加快该反应的速率,催化剂Y的化学式为_________。
【实验二】测定某乙二酸晶体(H2C2O4·xH2O)中的x值,具体操作如下:
(5)滴定:称取2.52g 乙二酸晶体,配成100mL溶液,准确量取25.00mL乙二酸溶液于锥形瓶中,加少量酸酸化,将0.1mol/L KMnO4标准溶液装入_____(填“酸式”或“碱式”)滴定管,进行滴定操作。在实验中发现,刚滴下少量KMnO4溶液时,需将锥形瓶摇动一段时间后,紫红色才慢慢褪去,再继续滴加时,紫红色就很快褪去了。出现上述现象的原因是_______。待到______,证明达到滴定终点。
(6)计算:再重复上述操作3次,记录数据如下表:
实验次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 0.00 | 20.10 |
2 | 1.00 | 20.90 |
3 | 0.20 | 20.20 |
4 | 0.00 | 22.10 |
则x为__________。
(7)误差分析:下列操作会导致测量的乙二酸溶液浓度偏高的是_______(填序号)
A.配制KMnO4标准溶液定容时,仰视观察刻度线
B.不小心将少量酸性KMnO4标准溶液滴到锥形瓶外
C.滴定前锥形瓶中有少量蒸馏水
D.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
E.观察读数时,滴定前仰视读数,滴定后俯视读数