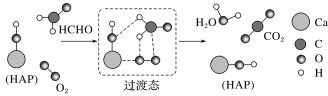
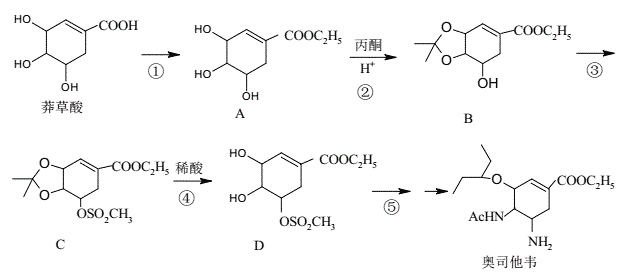
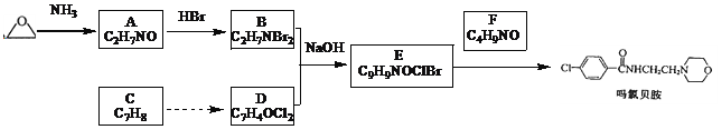
题目内容
【题目】已知2SO2(g)+ O2 (g)![]() 2SO3 (g);△H=﹣197kJmol﹣1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3。恒温、恒容下反应达到平衡时,下列关系一定正确的是
2SO3 (g);△H=﹣197kJmol﹣1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2mol SO2和1mol O2;(乙) 1mol SO2和0.5mol O2;(丙) 2mol SO3。恒温、恒容下反应达到平衡时,下列关系一定正确的是
A.容器内压强P:P甲=P丙>2P乙
B.反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
C.c(SO2)与c(O2)之比k:k甲=k丙>k乙
D.SO3的质量m:m甲=m丙>2m乙
【答案】D
【解析】
丙容器中2mol SO3折算成反应物为2mol SO2和1mol O2与甲容器相同,所以达到平衡时与甲为等效平衡,乙容器起始量为甲的一半,平衡时压强小于甲,由于该反应的正反应为体积减小的反应,所以乙容器中反应正向进行的程度小于甲,所以乙容器中压强大于甲容器压强的一半,SO3的质量小于甲的一半,平衡常数只受温度影响,与反应起始量无关,由于甲和丙是从相反方向到达的等效平衡,所以它们热量的数值之和应等于反应的反应热,据此答题。
丙容器中2mol SO3折算成反应物为2mol SO2和1mol O2与甲容器相同,所以达到平衡时与甲为等效平衡,乙容器起始量为甲的一半,平衡时压强小于甲,由于该反应的正反应为体积减小的反应,所以乙容器中反应正向进行的程度小于甲,所以乙容器中压强大于甲容器压强的一半,SO3的质量小于甲的一半,平衡常数只受温度影响,与反应起始量无关,由于甲和丙是从相反方向到达的等效平衡,所以它们热量的数值之和应等于反应的反应热,所以有:
A.容器内压强P:P甲=P丙<2P乙,故A错误;
B.甲与丙为等效平衡,平衡时对应各组分的物质的量相等,故Q甲+Q丙=197,甲等效为在乙的基础上增大一倍压强,平衡向正反应移动,SO2转化率增大,故Q甲>2Q乙,故B错误;
C.对于甲、乙,SO2、O2起始物质的量之比等于化学计量数之比,c(SO2)与c(O2)之比为定值2:1,丙为分解反应,丙中c(SO2)与c(O2)之比为2:1,故k甲=k丙=k乙=2,故C错误;
D.SO3的质量m:m甲=m丙>2m乙,故D正确;
故答案为D。

 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案【题目】下列表格中的各种情况,可以用右图的曲线表示的是 ( )
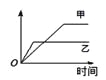
反 应 | 纵坐标 | 甲 | 乙 | |
A | 相同质量的氨,在同一容器中 | 氨气的转化率 | 500℃ | 400℃ |
B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
C | 在体积可变的恒压容器中,体积比1︰3的N2、H2, | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
D | 2 molSO2和1 molO2,在相同温度下2SO2+ O2 | SO3物质的量 | 2个大气压 | 10个大气压 |
A. AB. BC. CD. D