题目内容
76.8g铜与适量浓硝酸反应,铜全部溶解,若NO3-减少2mol,则溶液中H+减少了( )
| A、2.2mol |
| B、3.2mol |
| C、4.4mol |
| D、4.8mol |
考点:化学方程式的有关计算
专题:计算题
分析:反应中硝酸起氧化剂与酸的作用,NO3-减少2mol,说明起氧化剂作用的硝酸为2mol,根据Cu元素守恒计算硝酸铜的物质的量,再根据硝酸根守恒计算起酸性作用的硝酸,溶液中减少的氢离子的物质的量等于参加反应硝酸的物质的量.
解答:
解:反应中硝酸起氧化剂与酸的作用,NO3-减少2mol,说明起氧化剂作用的硝酸为2mol,76.8gCu的物质的量=
=1.2mol,则硝酸铜物质的量=1.2mol,由硝酸根守恒离子,其酸性作用的硝酸为1.2mol×2=2.4mol,故参加反应硝酸为2mol+2.4mol=4.4mol,故溶液中溶液中H+减少了4.4mol,
故选C.
| 76.8g |
| 64g/mol |
故选C.
点评:本题考查化学方程式有关计算,难度中等,注意利用守恒思想解答,避免判断生成的气体而简化计算.

练习册系列答案
相关题目
下列措施或事实不能用勒夏特列原理解释的是( )
| A、在合成氨的反应中,降温或加压有利于氨的合成 |
| B、H2、I2、HI平衡混合气加压后颜色变深 |
| C、Fe(SCN)3溶液中加入固体KSCN后颜色变深 |
| D、阴暗处密封有利于氯水的储存 |
已知反应3Cl2+6NaOH=5NaCl+NaClO3+3H2O下列说法不正确的是( )
| A、Cl2既是氧化剂,也是还原剂 |
| B、被还原的氯原子数是被氧化的氯原子数的5倍 |
| C、NaCl是还原产物,NaClO3氧化产物 |
| D、氧化剂和还原剂的质量比是1:5 |
下列氧化还原反应中,电子得失情况表示不正确的是( )
A、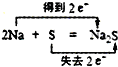 |
B、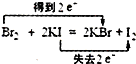 |
C、 |
D、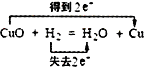 |
下列分散系不属于胶体的是( )
| A、淀粉溶液 | B、有色玻璃 |
| C、饱和食盐水 | D、肥皂水 |
下面有关Na2CO3与NaHCO3的性质比较中错误的是( )
| A、相同浓度溶液的碱性:Na2CO3>NaHCO3 |
| B、同温下在水中的溶解度:Na2CO3>NaHCO3 |
| C、滴加同浓度的硫酸,反应先放出气泡的是Na2CO3 |
| D、热稳定性:NaHCO3<Na2CO3 |
下列反应中亚硫酸溶液表现的性质与另外三种不同的是( )
| A、能使酸性高锰酸钾溶液褪色 |
| B、在空气中久置,溶液pH变小 |
| C、能使溴水褪色 |
| D、加入氢氧化钡溶液产生白色沉淀 |
向含有NaBr和KI的混合溶液中通入氯气充分反应后将溶液蒸干,并灼烧所得物质,最后剩余的固体可能是( )
| A、NaCl和KI |
| B、NaCl和I2 |
| C、KCl和NaBr |
| D、KCl和I2 |