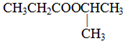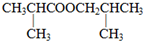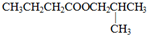题目内容
下列氧化还原反应中,电子得失情况表示不正确的是( )
A、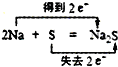 |
B、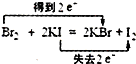 |
C、 |
D、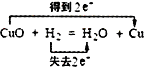 |
考点:氧化还原反应的电子转移数目计算
专题:氧化还原反应专题
分析:氧化还原反应中失电子的元素化合价升高,得电子的元素化合价降低,化合价降低数目=化合价升高数目=转移的电子数目.
解答:
解:A.S元素化合价由0价降低为-2价,得到电子,钠元素化合价从0价升高为+1价,失去电子,转移电子为2e-,故A错误;
B.溴元素化合价由0价降低为-1价,得到电子,碘元素化合价从-1价升高为0价,失去电子,转移电子为2e-,故B正确;
C.铜元素化合价由+2价降低为0价,得到电子,锌元素化合价从0价升高为+2价,失去电子,转移电子为2e-,故C正确;
D.铜元素化合价由+2价降低为0价,得到电子,氢元素化合价从0价升高为+1价,失去电子,转移电子为2e-,故D正确,
故选A.
B.溴元素化合价由0价降低为-1价,得到电子,碘元素化合价从-1价升高为0价,失去电子,转移电子为2e-,故B正确;
C.铜元素化合价由+2价降低为0价,得到电子,锌元素化合价从0价升高为+2价,失去电子,转移电子为2e-,故C正确;
D.铜元素化合价由+2价降低为0价,得到电子,氢元素化合价从0价升高为+1价,失去电子,转移电子为2e-,故D正确,
故选A.
点评:本题考查氧化还原反应的特征和实质知识,中等难度.关键是判断准化合价变化的总数.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A、7.8g Na2O2含有的阴离子数目为0.2NA |
| B、电解精炼铜时每转移NA个电子,阳极溶解32g铜 |
| C、14g乙烯和丙烯(C3H6)的混合物中含有的原子数目为3NA |
| D、1L 0.5mol/L Na2CO3溶液中含有的CO32-数目为0.5NA |
NA为阿伏加德罗常数,下列说法正确的是( )
| A、100mL 1 mol?L-1的CH3COOH溶液中含有CH3COOH分子0.1NA |
| B、等物质的量的N2和CO的质量均为28g |
| C、25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| D、100mL 1mol/L的Na3PO4溶液中含有离子数多于0.4NA |
下列叙述中正确的是( )
| A、1mol任何纯净物都含有相同的分子数 |
| B、1molO2中约含有6.02×1023个氧分子 |
| C、1mol氢中含有2mol氢原子 |
| D、阿伏加德罗常数就是6.02×1023mol-1 |
下列说法正确的是( )
A、化合物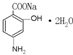 的核磁共振氢谱测出5个谱峰 的核磁共振氢谱测出5个谱峰 |
| B、实验室检验NH4HCO3溶液中NH4+的方法是取少量溶液,加热,并用湿润的红色石蕊试纸检证产生的气体,试纸变蓝,证明有NH4+ |
| C、在一定条件下,某可逆反应的△H=+100kJ?mol-1,则该反应正反应活化能比逆反应活化能大100kJ?mol-1 |
| D、等浓度的碳酸钠和碳酸氢钠溶液混合后的溶液中:2c(OH-)+c(CO32-)=c(HCO3-)+3c(H2CO3)+2c(H+) |
76.8g铜与适量浓硝酸反应,铜全部溶解,若NO3-减少2mol,则溶液中H+减少了( )
| A、2.2mol |
| B、3.2mol |
| C、4.4mol |
| D、4.8mol |
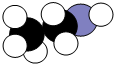 如图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子.关于该物质说法不正确为( )
如图是某有机物分子的比例模型,黑色的是碳原子,白色的是氢原子,灰色的是氧原子.关于该物质说法不正确为( )| A、不能使紫色石蕊变红 |
| B、与碳酸钠反应 |
| C、能发生酯化反应 |
| D、能发生氧化反应催化剂 |
下列实验操作或装置错误的是( )
A、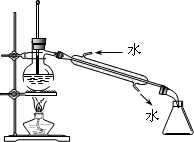 蒸馏 |
B、 过滤 |
C、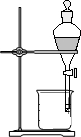 萃取 |
D、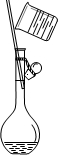 转移溶液 |