题目内容
2.有A,B,C,D,E,F六种有机物,A,B 是两种气态烃,他们的密度都小于空气的密度,A,B分别和相同物质的量的氯化氢发生加成反应后,A的生成物C能发生聚合反应,B的生成物D不能.B在加热加压和有催化剂的条件下,能和水作用生成E,E在加热和有铜作催化剂的条件下被空气氧化成F.写出A,B,C,E的结构简式(1)ACH≡CHBCH2=CH2CCHCl=CH2 ECH3CH2OH.
(2)写出下列化学方程式:
A到CCH≡CH+HCl$\stackrel{催化剂}{→}$CHCl=CH2;
C的聚合反应nCHCl=CH2$\stackrel{引发剂}{→}$
 ;
;B到ECH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH;
E到F2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO.
分析 A,B 是两种气态烃,他们的密度都小于空气的密度,A、B分别和相同物质的量的氯化氢发生加成反应后,A的生成物C能发生聚合反应,B的生成物D不能,说明A是乙炔,结构简式为CH≡CH,其与HCl加成生成的化合物C为CHCl=CH2,B为乙烯,结构简式为CH2=CH2,其与氯化氢加成生成的D为CH3CH2Cl,乙烯与水发生加成反应生成乙醇,所以E为CH3CH2OH,E在Cu作催化剂时催化氧化生成乙醛,所以F为CH3CHO,据此分析.
解答 解:A,B 是两种气态烃,他们的密度都小于空气的密度,A、B分别和相同物质的量的氯化氢发生加成反应后,A的生成物C能发生聚合反应,B的生成物D不能,说明A是乙炔,结构简式为CH≡CH,其与HCl加成生成的化合物C为CHCl=CH2,B为乙烯,结构简式为CH2=CH2,其与氯化氢加成生成的D为CH3CH2Cl,乙烯与水发生加成反应生成乙醇,所以E为CH3CH2OH,E在Cu作催化剂时催化氧化生成乙醛,所以F为CH3CHO,
(1)A是乙炔,结构简式为CH≡CH,其与HCl加成生成的化合物C为CHCl=CH2,B为乙烯,结构简式为CH2=CH2,其与氯化氢加成生成的D为CH3CH2Cl,乙烯与水发生加成反应生成乙醇,所以E为CH3CH2OH,故答案为:CH≡CH;CH2=CH2;CHCl=CH2;CH3CH2OH;
(2)A是乙炔,结构简式为CH≡CH,其与HCl加成生成的化合物C为CHCl=CH2,化学方程式为CH≡CH+HCl$\stackrel{催化剂}{→}$CHCl=CH2,
C为CHCl=CH2,其发生加聚反应生成聚氯乙烯的化学方程式为nCHCl=CH2$\stackrel{引发剂}{→}$ ,
,
乙烯与水发生加成反应生成乙醇,所以E为CH3CH2OH,化学方程式为CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH,
CH3CH2OH在Cu作催化剂时催化氧化生成乙醛,化学方程式为2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO,
故答案为:CH≡CH+HCl$\stackrel{催化剂}{→}$CHCl=CH2;nCHCl=CH2$\stackrel{引发剂}{→}$ ;CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH;2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO.
;CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH;2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO.
点评 本题考查有机物的推断,难度不大,确定有机物中含有的官能团是正确推断的关键,顺推可得其它物质.

| A. | 第3列所含元素种类最多 | B. | 第1列元素中全为金属元素 | ||
| C. | 第15的气态氢化物为RH3 | D. | 第17列元素的第一种元素无含氧酸 |
| A. | 反应BaSO4(s)+4C(s)═BaS(s)+4CO(g)在室温下不能自发进行,说明该反应的△H<0 | |
| B. | 已知室温时氢氧化铁的溶度积常数为2.6×10-39,为除去某酸性CuCl2溶液中少量的氯化铁,可加入适量碱式碳酸铜调节溶液的pH到4,使Fe3+转化为氢氧化铁沉淀,此时溶液中的c(Fe3+)为2.6×10-8 mol/L | |
| C. | 相同物质的量浓度的下列溶液:①NH4Al(SO4)2②NH4Cl ③NH3•H2O,c(NH4+)由大到小的顺序是:①>②>③ | |
| D. | 向Cu(OH)2悬浊液中加入胆矾,则平衡左移,氢氧化铜的溶解度不变 |

①高温煅烧时的反应原理为:Li2O•Al2O3•SiO2+K2SO4=K2O•Al2O3•SiO2+Li2SO4
Li2O•Al2O3•SiO2+Na2SO4=Na2O•Al2O3•SiO2+Li2SO4
②锂离子浸取液中含有的金属离子为:K+、Na+、Li+、Fe3+、Fe2+、Al3+、Mn2+.
③几种金属离子沉淀完全的pH
| 金属离子 | Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 |
| 沉淀完全的pH | 4.7 | 9.0 | 3.2 | 10.1 |
| 温度 溶解度 | 10 | 20 | 50 | 80 |
| Li2SO4 | 35.4 | 34.7 | 33.1 | 31.7 |
| Li2CO3 | 1.43 | 1.33 | 1.08 | 0.85 |
(2)滤渣2的主要成分为Al(OH)3、Fe(OH)3.
(3)流程中分2次调节pH(pH7~8和pH>13),有研究者尝试只加一次浓NaOH溶液使pH>13,结果发现在加饱和碳酸钠溶液沉锂后,随着放置时间延长,白色沉淀增加,最后得到的Li2CO3产品中杂质增多.Li2CO3产品中的杂质可能是Al(OH)3,用离子方程式表示其产生的原因Al3++4OH-=AlO2-+2H2O2AlO2-+CO2+3H2O=2Al(OH)3↓+CO32-.
(4)加热浓缩的作用是提高Li+浓度和溶液温度,使得Li2CO3容易成淀.
(5)洗涤Li2CO3晶体使用热水.
| A. | 铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 | |
| B. | 常用的二次电池铅蓄电池充电时电池正极与电源负极相接 | |
| C. | 用铂电极电解CuSO4溶液,当Cu2+浓度降低至原来一半时,加入CuO使溶液恢复到原来浓度和质量 | |
| D. | 在轮船船壳吃水线下焊上铜块可避免船体遭受腐蚀 |
| A. | 酸性氧化物:CO2、SO2、SiO2、Cl2O7 | |
| B. | 混合物:铝热剂、纯净矿泉水、水玻璃、焦炉气 | |
| C. | 同素异形体:石墨与金刚石、氧气与臭氧 | |
| D. | 非电解质:蔗糖、四氯化碳、氨气、氯气 |
| A. | 0.1 mol•L-1氯化铵溶液中:c(H+)>c(OH-)>c(Cl-)>c(NH4+) | |
| B. | pH=2的醋酸中:c(H+)=0.02mol•L-1 | |
| C. | 饱和碳酸钠溶液中:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| D. | pH=12的NaOH溶液与pH=2 CH3COOH混合后所得溶液中:c(H+)<c(OH-) |
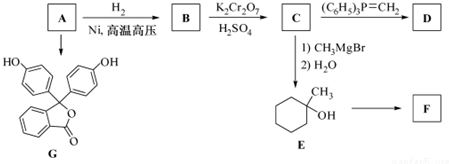
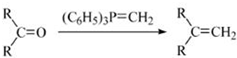

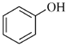 .
.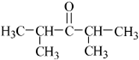 或
或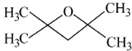 (任写一种).
(任写一种).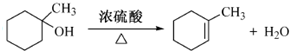 .
. 氢能的存储是氢能应用的主要瓶颈,2008年,Yoon等人发现Ca与C60生成的Ca32C60能大量吸附H2分子.
氢能的存储是氢能应用的主要瓶颈,2008年,Yoon等人发现Ca与C60生成的Ca32C60能大量吸附H2分子.