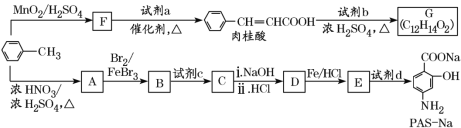
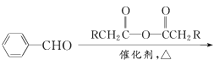
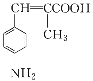
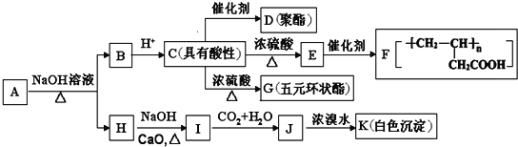
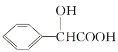
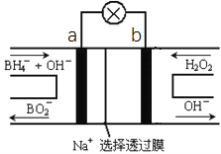
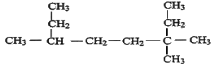
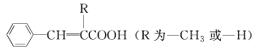题目内容
【题目】在酸性介质中,H2O2能使 KMnO4溶液褪色,离子反应(未配平)为:MnO![]() + H+ + H2O2→Mn2++ O2 + H2O,下列说法错误的是
+ H+ + H2O2→Mn2++ O2 + H2O,下列说法错误的是
A.氧化性比较:MnO![]() > O2
> O2
B.该反应中酸性介质可以为盐酸
C.氧化剂与还原剂的物质的量之比为2∶5
D.若有0.1 mol氧化产物生成, 则转移电子0.2 mol
【答案】B
【解析】
MnO![]() + H++ H2O2→Mn2++ O2+ H2O反应中Mn元素的化合价由+7价降低为+2价, O元素的化合价由-1价升高为0价,配平得:2MnO
+ H++ H2O2→Mn2++ O2+ H2O反应中Mn元素的化合价由+7价降低为+2价, O元素的化合价由-1价升高为0价,配平得:2MnO![]() + 6H++ 5H2O2=2Mn2++ 5O2+8 H2O,据此分析解答。
+ 6H++ 5H2O2=2Mn2++ 5O2+8 H2O,据此分析解答。
A.该反应中,MnO![]() 中Mn元素的化合价由+7价降低为+2价,得电子,为氧化剂,H2O2中O元素的化合价由-1价升高为0价,失电子,为还原剂,则氧气为氧化产物,氧化剂的氧化性大于氧化产物的氧化性,所以氧化性比较:MnO
中Mn元素的化合价由+7价降低为+2价,得电子,为氧化剂,H2O2中O元素的化合价由-1价升高为0价,失电子,为还原剂,则氧气为氧化产物,氧化剂的氧化性大于氧化产物的氧化性,所以氧化性比较:MnO![]() >O2,故A正确;
>O2,故A正确;
B.高锰酸钾能够将氯离子氧化生成氯气,该反应中酸性介质不能为盐酸,一般用硫酸,故B错误;
C.MnO![]() 为氧化剂,H2O2为还原剂,根据得失电子守恒,氧化剂与还原剂的物质的量之比为[0-(-1)]×2∶[(+7)-(+2)]=2 ∶5,故C正确;
为氧化剂,H2O2为还原剂,根据得失电子守恒,氧化剂与还原剂的物质的量之比为[0-(-1)]×2∶[(+7)-(+2)]=2 ∶5,故C正确;
D.配平后的方程式为2MnO![]() + 6H++ 5H2O2=2Mn2++ 5O2+8 H2O,反应中转移10个电子,若有0.1mol氧化产物O2生成,则转移电子0.2mol,故D正确;
+ 6H++ 5H2O2=2Mn2++ 5O2+8 H2O,反应中转移10个电子,若有0.1mol氧化产物O2生成,则转移电子0.2mol,故D正确;
故选B。

【题目】氮的氧化物和氮的氢化物的任意排放均会对环境造成污染,因此关于其转化的研究对于消除环境污染有着重要意义。
(1)已知T℃时,有如下反应:
反应I:4NH3(g) + 6NO(g)![]() 5N2 ( g) + 6H2O(g) △H = -1804 kJmol-1
5N2 ( g) + 6H2O(g) △H = -1804 kJmol-1
反应II:N2(g) +2O2(g) ![]() 2NO2(g) △H = +67.8 kJmol-1
2NO2(g) △H = +67.8 kJmol-1
反应III:2NO(g) + O2 (g) ![]() 2 NO2 (g) △H =-116.2 kJmol-1
2 NO2 (g) △H =-116.2 kJmol-1
试写出T℃ 时,NH3与NO2反应生成不污染环境的物质的热化学反应方程式 ______。
(2)T℃时,向2L密闭容器中加入一定量的NO2、NO和O2,发生(1)中反应III,不同时间测得各物质的部分浓度(molL-1) 如下表所示:
时间( min) | NO | O2 | NO2 |
0 | a | 0.30 | 0.10 |
10 | 0.14 | 0.27 | b |
20 | 0.10 | c | 0.20 |
30 | d | 0.24 | 0.22 |
40 | 0.08 | e | f |
①温度不变,反应达平衡后容器中的压强与最初加入气体时的压强之比为_______。
②反应的前 20 min 的平均反应速率v(NO)=________molL-1·min-1。
③若温度不变,平衡后将反应容器压缩为1L,达到新的平衡后,c(O2)_____0.48molL-1(填“>”“<”或“ =”)。
(3)某化学兴趣小组利用电解原理设计实验消除NH3 与 NO对环境的影响, 并制取KOH溶液和H2SO4溶液,其工作原理如下图所示:
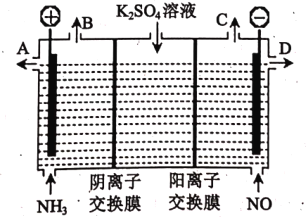
①从出口B、C产生的气体相同,该气体是_____:从出口 D 得到的溶液是____。
②电解槽左池中发生的电极反应式为________ 。
③电解一段时间,两电极共收集到22.4L气体(标准状况下)时,理论上将生成____________mol KOH。