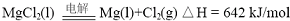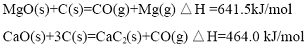题目内容
| (2012?江苏一模)在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)?Ni(CO)4(g),已知该反应平衡常数与温度的关系如表1: 表1 平衡常数与温度的关系
|
分析:A.由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,据此判断;
B.相同温度下,对于同一可逆反应的正、逆反应平衡常数互为倒数;
C.计算常数的浓度商Qc,与平衡常数比较,判断反应进行方向,据此判断;
D.根据80°C平衡常数计算Ni(CO)4的平衡浓度.
B.相同温度下,对于同一可逆反应的正、逆反应平衡常数互为倒数;
C.计算常数的浓度商Qc,与平衡常数比较,判断反应进行方向,据此判断;
D.根据80°C平衡常数计算Ni(CO)4的平衡浓度.
解答:解:A.由表中数据可知,温度越高平衡常数越小,说明升高温度平衡向逆反应移动,升高温度平衡向吸热反应移动,故正反应为放热反应,故A错误;
B.25°C时反应Ni(s)+4CO(g)?Ni(CO)4(g)的平衡常数为5×104,相同温度下,对于同一可逆反应的正、逆反应平衡常数互为倒数,故25°C时反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数为
=2×10-5,故B正确;
C.浓度商Qc=
=8,大于80°C平衡常数2,故反应进行方向逆反应进行,故v(正)<v(逆),故C错误;
D.80°C达到平衡时,测得n(CO)=0.3mol,c(CO)=
=1mol/L,故c[Ni(CO)4]=K?c4(CO)=2×14mol/L=2mol/L,故D正确;
故选AC.
B.25°C时反应Ni(s)+4CO(g)?Ni(CO)4(g)的平衡常数为5×104,相同温度下,对于同一可逆反应的正、逆反应平衡常数互为倒数,故25°C时反应Ni(CO)4(g)?Ni(s)+4CO(g)的平衡常数为
| 1 |
| 5×104 |
C.浓度商Qc=
| 0.5 |
| 0.54 |
D.80°C达到平衡时,测得n(CO)=0.3mol,c(CO)=
| 0.3mol |
| 0.3L |
故选AC.
点评:本题考查化学平衡常数及影响因素、化学平衡常数有关计算等,难度中等,注意掌握化学平衡常数的应用.

练习册系列答案
相关题目


 ,则异蒲勒醇的结构简式为
,则异蒲勒醇的结构简式为
 的合成路线流程图.(无机试剂任用,合成路线流程图示例如下:
的合成路线流程图.(无机试剂任用,合成路线流程图示例如下: )
)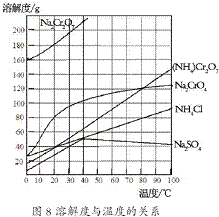 (2012?江苏一模)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作有机合成催化剂、实验室制纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取.有关物质溶解度如图所示.实验步骤如下:
(2012?江苏一模)重铬酸铵[(NH4)2Cr2O7]是一种桔黄色结晶,可用作有机合成催化剂、实验室制纯净的N2及Cr2O3等.实验室可由工业级铬酸钠(Na2CrO4)为原料制取.有关物质溶解度如图所示.实验步骤如下: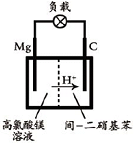 (2012?江苏一模)镁及其合金广泛应用于航空航天、交通、电池等行业,金属镁的制备方法主要有:
(2012?江苏一模)镁及其合金广泛应用于航空航天、交通、电池等行业,金属镁的制备方法主要有: