题目内容
铝是一种重要的金属,在生产、生活中具有许多重要的用途,下图是从铝土矿中制备铝的工艺流程:
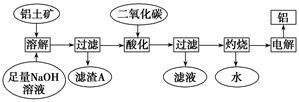
已知:铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(1) 写出向铝土矿中加入足量氢氧化钠溶液操作中发生反应的离子方程式:__________________________;_____________________________。
(2)在工艺流程第三步中,选用二氧化碳作酸化剂的原因是:_________。
(3)若将铝溶解,下列试剂中最好选用________(填编号)。理由是_________________。

已知:铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质;
(1) 写出向铝土矿中加入足量氢氧化钠溶液操作中发生反应的离子方程式:__________________________;_____________________________。
(2)在工艺流程第三步中,选用二氧化碳作酸化剂的原因是:_________。
(3)若将铝溶解,下列试剂中最好选用________(填编号)。理由是_________________。
| A.浓硫酸 | B.稀硫酸 | C.稀硝酸 | D.浓硝酸 |
(1)Al2O3+2OH-===2AlO+H2O
SiO2+2OH-===SiO+H2O
(2)经过足量氢氧化钠溶液的溶解,大部分铝元素均以NaAlO2的形式存在于滤液中,通入过量二氧化碳可以将NaAlO2完全转化为Al(OH)3
(3) B 铝与浓硫酸、浓硝酸在常温下发生钝化;稀硝酸与铝会产生NO气体,污染空气。
SiO2+2OH-===SiO+H2O
(2)经过足量氢氧化钠溶液的溶解,大部分铝元素均以NaAlO2的形式存在于滤液中,通入过量二氧化碳可以将NaAlO2完全转化为Al(OH)3
(3) B 铝与浓硫酸、浓硝酸在常温下发生钝化;稀硝酸与铝会产生NO气体,污染空气。
试题分析:(1)铝土矿主要成份是Al2O3还有少量Si02,加入足量氢氧化钠溶液后发生如下反应:
Al2O3+2OH-===2AlO+H2O ; SiO2+2OH-===SiO+H2O; Fe2O3不与氢氧化钠溶液发生反应。
(2)经过足量氢氧化钠溶液的溶解,大部分铝元素均以NaAlO2的形式存在于滤液中,通入过量二氧化碳可以将NaAlO2完全转化为Al(OH)3
(3)浓硫酸、浓硝酸均能使铝发生钝化,而稀硝酸与铝会产生NO气体,污染空气,因而最好选B稀硫酸。
点评:铝是历年高考的重点和难点,注意加强学习铝的化学性质和化学实验。

练习册系列答案
 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案 导学教程高中新课标系列答案
导学教程高中新课标系列答案
相关题目
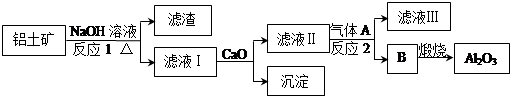
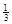 Na3AlH6 (s)+
Na3AlH6 (s)+ 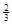 Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1
Al (s) + H2(g) ΔH=+ 37 kJ·molˉ1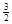 H2(g) ΔH=+ 70.5 kJ·molˉ1
H2(g) ΔH=+ 70.5 kJ·molˉ1