题目内容
【题目】为应对全球气候变暖,科学家在综合利用 CO2 方面取得了不少研究成果。如用 CO2 合成重要化工原料 CH3OH,同时生成 CO,反应如下:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)+Q1kJ(Q1>0),
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g)-Q2kJ(Q2>0)。
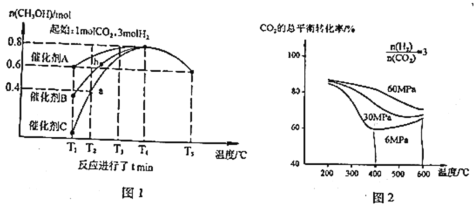
研究催化剂等外界条件对上述反应的影响,结果如图 1、图 2
完成下列填空:
(1)一定是碳12的同位素原子是_____(选填“A”、“B”、“C”、“D”)
A.质子数为6,中子数为8 B.质子数为8,中子数为12
C.质子数为12,中子数为6 D.质子数为12,中子数为8
(2)分析图1:催化效果最佳的是催化剂_____(选填“A”、“B”、“C”)。若密闭容器体积为2L,则a点测得CH3OH的平均生成速率为_____mol·L-1·min-1。b点反应_____(填“达到”或“未达到”)平衡状态,理由是:_____
(3)分析图2:相同温度下,增大原料气压强,反应Ⅰ平衡常数_____(选填“增大”、“减小”、“不变”、“无法判断”);当压强为6Mpa、温度在400~600℃时,CO2的总体平衡转化率随温度升高而增大的原因是___________________________________
(4)若生成的CH3OH和CO物质的量之比为4:1,则消耗相同条件下的CO2和H2体积比是_____
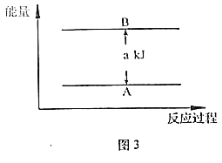
(5)若有88gCO2发生反应Ⅰ,并放出akJ热量,则图3中A为_____,B为_____
【答案】A A ![]() 未达到 此温度催化剂A得到的甲醇更多,即b若时间增加,在此条件下可以得到更多的生成物(合理即可) 不变 反应Ⅱ中
未达到 此温度催化剂A得到的甲醇更多,即b若时间增加,在此条件下可以得到更多的生成物(合理即可) 不变 反应Ⅱ中![]() 增大的平衡转化率大于反应Ⅰ中
增大的平衡转化率大于反应Ⅰ中![]() 减小的平衡转化率
减小的平衡转化率 ![]()
![]()
![]()
【解析】
(1)质子数相同而中子数不同的同一元素的不同原子互为同位素;
(2)相同温度下甲醇的产量越高,催化剂的催化效果越好。根据v=![]() =
=![]() 计算;反应达到平衡状态时,各组分的含量保持不变,b点对应温度下使用催化剂A时甲醇物质的量大于b点,b点之后随时间的增加,在此条件下可以得到更多的生成物,据此分析解答;
计算;反应达到平衡状态时,各组分的含量保持不变,b点对应温度下使用催化剂A时甲醇物质的量大于b点,b点之后随时间的增加,在此条件下可以得到更多的生成物,据此分析解答;
(3)平衡常数只与温度有关,温度不变,平衡常数不变;根据反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)+Q1kJ(Q1>0)为气体分子数目减小的放热反应,反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g)-Q2kJ(Q2>0)为气体分子数不变的吸热反应,根据外界条件对反应平衡移动的影响分析;
(4)结合反应Ⅰ和反应Ⅱ,根据“三段式”分析解答;
(5)反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)+Q1kJ(Q1>0)为放热反应,反应物的总能量大于生成物的总能量,结合参与反应的CO2的量计算分析解答。
(1)质子数相同而中子数不同的同一元素的不同原子互为同位素,碳原子的质子数为6,碳12的质子数为6、中子数为6,与碳12互为同位素原子质子数也应为6、中子数不为6,符合题意的只有A,答案选A;
(2)相同温度下甲醇的产量越高,催化剂的催化效果越好,如图所示,T1温度时,在催化剂A的作用下甲醇的产量最高,则A的催化作用最好;根据图示,经过tmin,a点测得生成CH3OH的物质的量为0.4mol,根据v=![]() =
=![]() , a点时CH3OH的平均生成速率为
, a点时CH3OH的平均生成速率为![]() =
=![]() mol·L-1·min-1;反应达到平衡状态时,各组分的含量保持不变,根据图示,b点对应温度下使用催化剂A时甲醇物质的量大于b点,说明b点之后随时间的增加,在此条件下可以得到更多的生成物,说明b点未达到平衡状态;
mol·L-1·min-1;反应达到平衡状态时,各组分的含量保持不变,根据图示,b点对应温度下使用催化剂A时甲醇物质的量大于b点,说明b点之后随时间的增加,在此条件下可以得到更多的生成物,说明b点未达到平衡状态;
(3)平衡常数只与温度有关,温度不变,平衡常数K不变;反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)+Q1kJ(Q1>0)为气体分子数目减小的放热反应,反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g)-Q2kJ(Q2>0)为气体分子数不变的吸热反应,6Mpa、温度在400~600℃时,升高温度,反应Ⅰ平衡逆向移动,CO2的转化率减小,反应Ⅱ的平衡正向移动,CO2的转化率增大,导致CO2的总体平衡转化率随温度升高而增大的原因可能是反应Ⅱ中![]() 增大的平衡转化率大于反应Ⅰ中
增大的平衡转化率大于反应Ⅰ中![]() 减小的平衡转化率;
减小的平衡转化率;
(4)若生成的CH3OH和CO物质的量之比为4:1,设CH3OH和CO物质的量分别为4mol和1mol,则:

反应过程中一共消耗CO25mol,消耗氢气13mol,同条件下,物质的量之比等于体积之比,则消耗相同条件下的CO2和H2体积比是5:13;
(5)反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)+Q1kJ(Q1>0)为气体分子数目减小的放热反应,即反应物的总能量大于生成物的总能量,若有88gCO2发生反应Ⅰ,并放出akJ热量,即参加反应的二氧化碳的物质的量=![]() =2mol,结合图示,则A为2CH3OH(g)+2H2O(g),B为2CO2(g)+6H2(g)。
=2mol,结合图示,则A为2CH3OH(g)+2H2O(g),B为2CO2(g)+6H2(g)。

 阅读快车系列答案
阅读快车系列答案