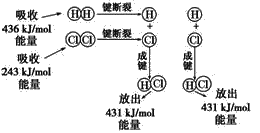
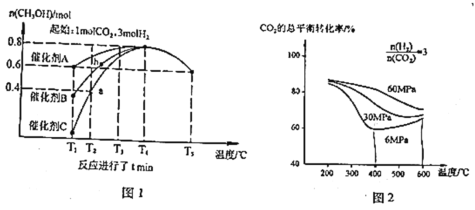
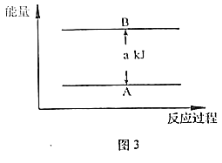
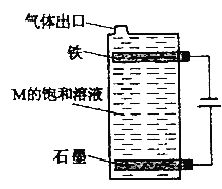
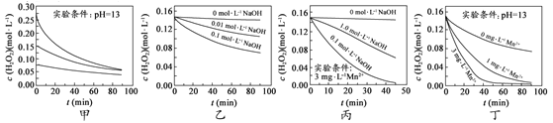
题目内容
【题目】如图所示,a、b为等质量的电极,电解槽中盛有1 L 1.0 mol·L-1CuSO4溶液,电解前后溶液体积变化忽略不计,下列有关叙述正确的是
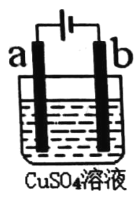
A.电子的流向:负极→b→a→正极
B.若为电解精炼铜装置,则a为粗铜;若为电镀铜装置,则b为纯铜
C.电镀铜或电解精炼铜,溶液中Cu2+浓度均不变
D.若为电镀铜,当电路中通过的电子为0.2mol时,两极的质量相差12.8g
【答案】D
【解析】
A.该装置为电解池,a极连接外加电源正极,b极连接外加电源负极,电子移动方向为负极→b,a→正极,电子不能通过电解质溶液,故A错误;
B.若为电解精炼铜的装置,粗铜作阳极,则a极为粗铜,若为电镀铜的装置,纯铜作阳极,则a极为纯铜,故B错误;
C.电镀铜时,溶液中铜离子浓度不变,电解精炼铜时,由于粗铜中含有Zn、Fe、Ag等杂质,锌、铁等失电子时,铜离子在阴极析出,因此溶液中铜离子浓度减小,故C错误;
D.若为电镀铜,a极的电极反应为Cu -2e-=Cu2+,b极的电极反应为Cu2++2e-=Cu,当电路中通过的电子为0.2mol时,a极消耗0.1mol铜,b极生成0.1mol铜,两个电极质量的差值为(0.1+0.1)mol×64g/mol=12.8g,故D正确;
答案选D。

练习册系列答案
相关题目