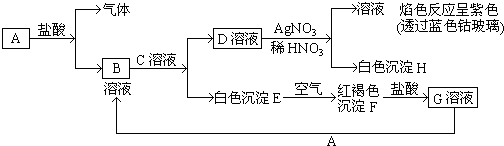
题目内容
【题目】某实验小组用0.50molL﹣1NaOH溶液和0.50molL﹣1硫酸进行中和热的测定.
(1)Ⅰ.配制0.50molL﹣1NaOH溶液
①配制0.50molL﹣1NaOH溶液时,需要使用的玻璃仪器除量筒、烧杯、玻璃棒外,还有 .
②若实验中约需要240ml0.50molL﹣1NaOH溶液,则应用量筒量取2.5molL﹣1NaOH溶液的体积为 .
(2)Ⅱ.测定中和热
取60mL NaOH溶液和40mL硫酸溶液进行实验,实验数据如表.
实验 | 起始温度t1/℃ | 终止温度 | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.3 | 26.0 | 26.1 | 30.1 |
2 | 27.0 | 27.3 | 27.2 | 33.3 |
3 | 25.9 | 25.9 | 25.9 | 29.8 |
4 | 26.5 | 26.2 | 26.3 | 30.4 |
① 近似认为0.50molL﹣1NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3 , 反应后溶液的比热容为4.18J/(g℃),则中和热△H= . (结果保留一位小数)
② 上述实验数值结果与57.3kJmol﹣1有偏差,产生此偏差的原因可能(填字母).
a.实验装置保温、隔热效果差
b.量取40mL0.50molL﹣1硫酸时俯视读数
c.硫酸倒入小烧杯时,有少量硫酸溅出
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
③ 现将一定量的稀氢氧化钠溶液、稀氢氧化钡溶液、稀氨水分别和1L 0.50mol/L的稀硫酸恰好完全反应,其反应热分别为△H1、△H2、△H3 , 则△H1、△H2、△H3由大到小的关系为 .
【答案】
(1)250ml容量瓶、胶头滴管;50.0ml
(2)﹣55.7kJ/mol;ad;△H3>△H1>△H2
【解析】解:Ⅰ.(1.)①配制250mL 0.50molL﹣1NaOH溶液的步骤为:计算、量取、稀释、转移、洗涤、振荡、定容、摇匀等,需要的仪器有:量筒、胶头滴管、烧杯、玻璃棒、250mL容量瓶等,其中玻璃仪器为:烧杯、量筒、玻璃棒、250mL容量瓶、胶头滴管.
所以答案是:250 mL容量瓶、胶头滴管;②由于无240mL容量瓶,故应选用250mL容量瓶,根据稀释定律,稀释前后溶质NaOH的物质的量不变,令需要NaOH溶液的体积为V,则:V×2.5molL﹣1=250mL×0.50molL﹣1 , 解得V=50.0mL,所以答案是:50.0 mL;
Ⅱ.(2.)①第一次测定温度差为:4.0℃,第二次测定的温度差为:6.1℃,第三次测定的温度差为:3.9℃,第四次测定的温度差为:4.1℃,实验2的误差太大要舍去,三次温度差的平均值为4.0℃,60mL,0.50molL﹣1NaOH溶液和40mL,0.50mol/L硫酸溶液进行中和反应,硫酸过量,生成水的物质的量为0.06L×0.50molL﹣1=0.03mol,溶液的质量为:100mL×1g/cm3=100g,温度变化的值为△T=4.0℃,则生成0.03mol水放出的热量为:Q=mc△T=100g×4.18J/(g℃)×4.0℃=1672J,即1.672kJ,所以实验测得的中和热△H=﹣ ![]() =﹣55.7kJ/mol,所以答案是:﹣55.7kJ/mol;
=﹣55.7kJ/mol,所以答案是:﹣55.7kJ/mol;
② a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.硫酸是过量的,量取40mL0.50molL﹣1硫酸时俯视读数偏高,不影响结果,故b错误;
c.硫酸过量,少量溅出,不影响结果,放出的热量基本不变,中和热的数值不变,故c错误;
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,硫酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故d正确.
所以答案是:ad;
③ 强酸与强碱的稀溶液发生中和反应热效应表示为:H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3KJmol﹣1 , 现将一定量的稀氢氧化钠溶液、稀氢氧化钡溶液、稀氨水分别和1L 0.50mol/L的稀硫酸恰好完全反应,因硫酸与氢氧化钡反应能生成沉淀放热,氨水电离放热,所以反应热:△H3>△H1>△H2;
所以答案是:△H3>△H1>△H2 .

【题目】根据下列实验现象,所得结论正确的是( )
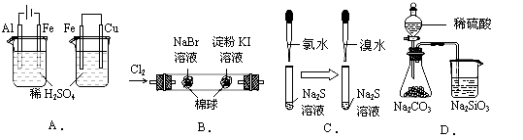
实验 | 实验现象 | 结论 |
A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 活动性:Al>Fe>Cu |
B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>Ⅰ2 |
C | 左边溶液产生黄色沉淀,右边溶液产生黄色沉淀 | 氧化性:Cl2>Br2>S |
D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:S>C>Si |