题目内容
【题目】(双选)4-溴甲基-1-环已烯的一种合成路线如下:
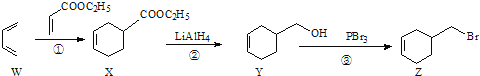
下列说法正确的是( )
A. 化合物X、Y、Z中均有一个手性碳原子
B. ①、②、③的反应类型依次为加成反应、还原反应和取代反应
C. 由化合物Z一步制备化合物Y的转化条件是:NaOH醇溶液,加热
D. 化合物Y先经酸性高锰酸钾溶液氧化,再与乙醇在浓硫酸催化下酯化可制得化合物X
【答案】AB
【解析】A、X、Y、Z连接支链的碳原子为手性碳原子,连接4个不同的原子或原子团,选项A正确;B、由官能团的转化可知①1,3-丁二烯与丙烯酸乙酯发生加成反应生成X,②X发生还原反应生成Y,③Y发生取代反应生成Z,选项B正确;C、由化合物Z一步制备化合物Y,应发生水解反应,应在氢氧化钠的水溶液中而不是在氢氧化钠的醇溶液中,选项C错误;D、Y含有碳碳双键,可被酸性高锰酸钾氧化,选项D错误。答案选AB。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】某实验小组用0.50molL﹣1NaOH溶液和0.50molL﹣1硫酸进行中和热的测定.
(1)Ⅰ.配制0.50molL﹣1NaOH溶液
①配制0.50molL﹣1NaOH溶液时,需要使用的玻璃仪器除量筒、烧杯、玻璃棒外,还有 .
②若实验中约需要240ml0.50molL﹣1NaOH溶液,则应用量筒量取2.5molL﹣1NaOH溶液的体积为 .
(2)Ⅱ.测定中和热
取60mL NaOH溶液和40mL硫酸溶液进行实验,实验数据如表.
实验 | 起始温度t1/℃ | 终止温度 | ||
H2SO4 | NaOH | 平均值 | ||
1 | 26.3 | 26.0 | 26.1 | 30.1 |
2 | 27.0 | 27.3 | 27.2 | 33.3 |
3 | 25.9 | 25.9 | 25.9 | 29.8 |
4 | 26.5 | 26.2 | 26.3 | 30.4 |
① 近似认为0.50molL﹣1NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3 , 反应后溶液的比热容为4.18J/(g℃),则中和热△H= . (结果保留一位小数)
② 上述实验数值结果与57.3kJmol﹣1有偏差,产生此偏差的原因可能(填字母).
a.实验装置保温、隔热效果差
b.量取40mL0.50molL﹣1硫酸时俯视读数
c.硫酸倒入小烧杯时,有少量硫酸溅出
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
③ 现将一定量的稀氢氧化钠溶液、稀氢氧化钡溶液、稀氨水分别和1L 0.50mol/L的稀硫酸恰好完全反应,其反应热分别为△H1、△H2、△H3 , 则△H1、△H2、△H3由大到小的关系为 .