题目内容
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A.2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA |
B.1 mol Na2CO3晶体中含C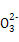 数小于NA 数小于NA |
| C.惰性电极电解食盐水,若线路中通过NA个电子,则阳极产生气体11.2 L |
| D.0.1 mol的CaO2中含阴离子数是0.2NA |
A
解析

练习册系列答案
相关题目
下列说法一定正确的是
A.反应A(s)  2B(g) + C(g),当C的体积分数不变时,反应达到平衡状态 2B(g) + C(g),当C的体积分数不变时,反应达到平衡状态 |
| B.将钢闸门与直流电源的正极相连,可防止钢闸门腐蚀 |
| C.将33.6LNO2溶于D2O中得到1L溶液,该溶液的物质的量浓度为1.0mol/L |
| D.在一定条件下,催化分解80g SO3,混合气体中氧原子数为3×6.02×1023 |
设阿伏加德罗常数的值为,则下列说法正确的是 ( )
A.标准状况下,22.4 L乙烯含有的共用电子对数为2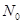 |
B.常温下,含有1 mol NaHSO4溶液中的阳离子数为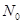 |
C.通常状况下,1 mol NO和0.5 molO2在密闭容器中混合,生成NO2分子数为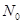 |
D.制取漂白粉时,标准状况下22.4 LCl2参加反应,转移电子数为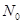 |
若用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A.1 mol BrCl与H2O完全反应生成氯化氢和次溴酸,转移的电子数为NA |
| B.锌与一定浓度的浓硫酸反应,产生标准状况下SO2和H2的混合气体22.4 L,锌失去电子数为2NA |
| C.常温常压下,20 g D2O含有的原子总数为3NA |
| D.标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数小于2NA |
设NA为阿伏加德罗常数的数值,若等质量的H2O和D2O分别与一定质量的金属钾完全反应,转移的电子数均为 NA,则下列各量不相等的是( )
NA,则下列各量不相等的是( )
| A.消耗H2O和D2O的物质的量 |
| B.同温同压下生成气体的体积 |
| C.反应后所得溶液中溶质的质量分数 |
| D.参加反应的钾的质量 |
下列有关化学用语的表示正确的是( )
A.S2-的结构示意图为: |
| B.质子数为53、中子数为78的碘原子:13153I |
C.F-的结构示意图: |
| D.由含有2个中子的氢原子与10个中子的氧原子形成的水分子的化学式可表示为:21H2188O |
设NA为阿伏加德罗常数的值,下列说法正确的是( )。
| A.某温度下,1 L pH=8的纯水中含OH-为10-8NA |
| B.14 g分子通式为CnH2n的链烃中含有的C=C键数目为NA |
| C.标准状况下,22.4 L Cl2与足量Fe反应,转移的电子数为3NA |
| D.常温下,1 L 0.1 mol·L-1 CH3COONa溶液中含有的Na+和CH3COO-总数为0.2NA |
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。利用如图所示装置加热硫酸铜粉末直至完全分解。若硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如表所示。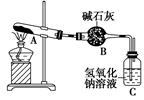
| 装置 | A(试管+粉末) | B | C |
| 反应前 | 42.0 g | 75.0 g | 140.0 g |
| 反应后 | 37.0 g | 79.5 g | 140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是( )
A.4CuSO4
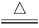 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑B.3CuSO4
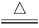 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑C.5CuSO4
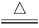 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑D.6CuSO4
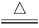 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑ 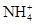 、
、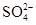 ,其浓度依次为:c(Na+)=2.3×10-5mol/L,c(Cl-)=3.5×10-5mol/L,
,其浓度依次为:c(Na+)=2.3×10-5mol/L,c(Cl-)=3.5×10-5mol/L,