题目内容
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。利用如图所示装置加热硫酸铜粉末直至完全分解。若硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如表所示。
| 装置 | A(试管+粉末) | B | C |
| 反应前 | 42.0 g | 75.0 g | 140.0 g |
| 反应后 | 37.0 g | 79.5 g | 140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是( )
A.4CuSO4
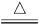 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑B.3CuSO4
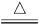 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑C.5CuSO4
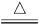 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑D.6CuSO4
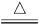 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑
A
解析

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
设NA为阿伏加德罗常数的值。下列说法正确的是
| A.1 mol·L-1的NaClO溶液中所含ClO-的数目为NA |
| B.标准状况下,2.24 L乙醇中含有的C—H数目为0.5NA |
| C.常温常压下,65 g Zn与足量浓H2SO4充分反应,转移电子数一定为2NA |
| D.2.24 L NO与1.12 L O2充分反应所得气体中原子数目一定为0.3NA |
设NA为阿伏加德罗常数的值,下列叙述中正确的是
| A.1mol丙烷含有的非极性共价键数目为NA |
| B.常温下,1.8 g H2O含有的电子数为NA |
| C.25℃时,pH=13的 Ba(OH)2溶液中含有的OH-数目为0.1 NA |
| D.2.24L氯气与过量的氢氧化钠溶液完全反应转移的电子数为0.1NA |
设NA为阿伏加德罗常数,下列叙述正确的是
| A.2.4g Mg与足量的二氧化碳完全反应失去的电子数为0.2NA |
| B.22.4 L氯气与过量的铁完全反应,转移电子数为2 NA |
| C.含NA个氧原子的O2与含NA个氧原子的O3的质量之比为2︰3 |
| D.1.8g1H218O中含有的中子数为NA |
设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A.0.5 mol/L MgCl2溶液中Cl-的数目为NA |
| B.58 g乙烯和乙烷的混合气体中碳原子数目一定为4NA |
| C.常温常压下,22.4 L NO和N2的混合气体中分子数目大于NA |
| D.标准状况下,0.5 mol氦气含有的电子数为NA |
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A.2.3 g金属钠与过量的氧气反应,无论加热与否转移电子数均为0.1NA |
B.1 mol Na2CO3晶体中含C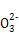 数小于NA 数小于NA |
| C.惰性电极电解食盐水,若线路中通过NA个电子,则阳极产生气体11.2 L |
| D.0.1 mol的CaO2中含阴离子数是0.2NA |
下列化学用语表示正确的是( )
A.Cl-的结构示意图: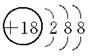 |
B.甲烷分子的球棍模型: |
C.氢氧化钠的电子式: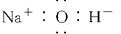 |
| D.次氯酸的结构式:H—O—Cl |
NA表示阿伏加德罗常数的值,下列说法正确的是( )。
| A.5.6 g铁粉在0.1 mol氯气中充分燃烧,转移电子数为0.3NA |
| B.常温常压下,1 mol氦气含有的核外电子数为4NA |
| C.7.8 g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA |
| D.0.5 mol雄黄(As4S4,结构如图)含有NA个S—S键 |
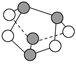
下列条件下,两种气体分子数一定不相等的是( )
| A.相同质量、不同密度的N2O和CO2 |
| B.相同体积、相同密度的CO和C2H4 |
| C.相同温度、相同压强、相同体积的O2和O3 |
| D.相同压强、相同体积、相同质量的NO2和N2O4 |