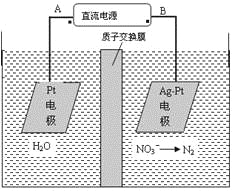
题目内容
【题目】下图是部分短周期元素的单质及化合物(或其溶液)的转化关系(部分反应条件已省略),其中A、B是单质,A的焰色反应为黄色,C、D是化合物,其它物质已经给出化学式,依据转化关系回答下列问题(出现A、B、C、D请用元素符号表示):
(1)C物质的名称________;①的基本反应类型________________
(2)形成单质B的元素在周期表中位于第________周期第________族。
(3)离子半径A+________O2- (填“<”“>”或“=”)。
(4)D的电子式________,A的原子结构示意图________
(5)D气体与氨气在空气中相遇发生反应,产生的现象是________________________A单质可以通过电解熔融ACl制取,化学反应方程式:________________________写出足量的D溶液与Na2CO3溶液反应的离子方程式:_______________________________
【答案】过氧化钠 化合反应 一 IA < ![]()
 冒白烟 2NaCl(熔融)
冒白烟 2NaCl(熔融) 2Na+Cl2↑ 2H++CO32-=CO2↑+H2O
2Na+Cl2↑ 2H++CO32-=CO2↑+H2O
【解析】
A为单质且焰色反应为黄色,则A为Na,钠与氧气加热反应生成C为Na2O2;NH3与HCl反应可以生成NH4Cl,所以D为HCl,则B为H2。
(1)C为Na2O2,名称为过氧化钠;反应①为氢气和氮气的化合反应;
(2)B为H2,H元素位于元素周期表第一周期第IA族;
(3)Na+与O2-核外电子层数相同,但O元素原子序数较小,所以离子半径Na+<O2-;
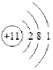
(4)D为HCl,为共价化合物,电子式为![]() ;Na原子结构示意图为
;Na原子结构示意图为 ;
;
(5)HCl气体与氨气在空气中相遇生成氯化铵固体,可观察到有白烟生成;电解熔融NaCl方程式为:2NaCl(熔融) 2Na+Cl2↑;足量HCl溶液与碳酸钠溶液反应生成二氧化碳和水,离子方程式为:2H++CO32-=CO2↑+H2O。
2Na+Cl2↑;足量HCl溶液与碳酸钠溶液反应生成二氧化碳和水,离子方程式为:2H++CO32-=CO2↑+H2O。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】Ⅰ.现有下列仪器或用品:①铁架台(含铁圈、各式铁夹) ②锥形瓶 ③酸式滴定管和碱式滴定管 ④烧杯 ⑤玻璃棒 ⑥胶头滴管 ⑦天平(含砝码) ⑧滤纸 ⑨量筒 ⑩过滤漏斗;
现有下列药品:(A)NaOH固体 (B)标准NaOH溶液(C)未知浓度盐酸 (D)蒸馏水(E)碳酸钠溶液
根据所做过的学生实验,回答下列问题:
(1)过滤时,应选用的上述仪器是_________________________(填编号)。
(2)配制一定物质的量浓度的NaOH溶液时,还缺少的仪器是__________。
(3)做酸碱中和滴定时,还缺乏的试剂是____________________。
(4)进行中和滴定时,绝不可用将要盛的溶液事先润洗的仪器是下列的______(填编号)。甲.酸式滴定管 乙.碱式滴定管 丙.锥形瓶
(5)用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞作为指示剂,造成测定结果偏高的原因可能是______________。
A.配制标准溶液的NaOH中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用未知液润洗
D.滴定前有气泡,滴定后气泡消失。
II. 甲醇(CH3OH)是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应I:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1
CH3OH(g)+H2O(g) ΔH1
反应II:CO(g)+2H2(g)![]() CH3OH(g) ΔH2
CH3OH(g) ΔH2
①反应I的平衡常数表达式为K=________________________
②下表所列数据是反应Ⅱ在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH2______0,ΔS______0 (填“>”、“=”或“<”=)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2 mol·L-1,则CO的转化率为________。
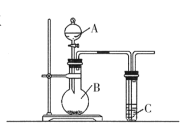
(2)已知在常温常压下,某实验小组依据甲醇燃烧的反应原理,设计如下图所示的电池装置:

①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =-1275.6 kJ·mol-1
②H2O(g)=H2O(l) ΔH =-44.0 kJ·mol-1
①写出表示甲醇燃烧热的热化学方程式____________________。
②写出上图电池装置中负极反应式:________________________________。
【题目】法医常用马氏试砷法检验是否砒霜( As2O3)中毒,涉及的反应如下:
I:6Zn+As2O3+12HCl=6ZnCl2+2AsH3(砷烷)↑+3H2O
Ⅱ:2AsH3=2As(黑色砷镜)+3H2
(1)写出砷的基态原子价电子排布图______________。
(2)砷烷的空间结构为_______;砷烷中心原子杂化方式为________。
(3)砷烷同族同系列物质相关性质如下表:
NH3 | PH3 | AsH3 | SbH3 | |
熔点/℃ | -77.8 | -133.5 | -116.3 | -88 |
沸点/℃ | -34.5 | -87.5 | -62.4 | -18.4 |
从PH3→AsH3→SbH3熔沸点依次升高的原因是_________;NH3分子例外的原因是_______。
(4)第一电离能数据I(As)>I(Se),可能的原因是_____________。
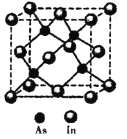
(5)砷与铟(In)形成的化合物(X)具有优良的光电性能,广泛应用于光纤通信用激光器,其晶胞结构如图所示,则其化学式为______;晶胞边长a= 666.67pm,则其密度为_____g/cm3(边长a可用![]() 近似计算,设NA=6.0×1023/mol)。
近似计算,设NA=6.0×1023/mol)。
【题目】下列图象中,纵坐标为沉淀物的量,横坐标为溶液中加入反应物的物质的量,试按题意将图象中相应的数字序号填入表中的顺序为
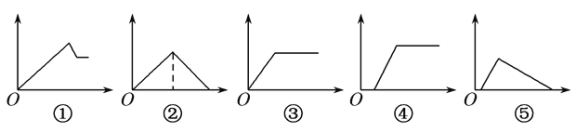
溶液 | 加入物质 | 相应序号 |
(1)氯化铝溶液 | 加入过量氨水 | |
(2)饱和澄清石灰水 | 通入过量CO2气体 | |
(3)含少量NaOH的偏铝酸钠溶液 | 通入过量CO2气体 | |
(4)含少量NaOH的偏铝酸钠溶液 | 逐滴加入稀盐酸 | |
(5)MgCl2、AlCl3的混合溶液 | 逐滴加入NaOH溶液至过量 |
A. ①③②④⑤ B. ③⑤④②①
C. ①②③④⑤ D. ③②④⑤①
【题目】人体血液中存在的平衡:H2CO3 ![]() HCO3-,使血液pH保持在7.35 ~ 7.45之间,否则就会发生酸中毒或碱中毒。已知pH随
HCO3-,使血液pH保持在7.35 ~ 7.45之间,否则就会发生酸中毒或碱中毒。已知pH随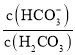 变化关系如表所示,则下列说法中错误的是
变化关系如表所示,则下列说法中错误的是
| 1.0 | 17.8 | 20.0 | 22.4 |
pH | 6.10 | 7.35 | 7.40 | 7.45 |
A.pH=7的血液中,c(HCO3-)>c(H2CO3)
B.正常体温下人体发生碱中毒时,c(H+)c(OH-)变大
C.人体发生酸中毒时,可静脉滴注一定浓度的NaHCO3溶液解毒
D.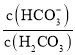 =20.0时,H2CO3的电离程度小于HCO3-的水解程度
=20.0时,H2CO3的电离程度小于HCO3-的水解程度