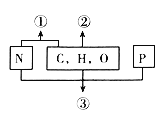
题目内容
【题目】铁、钴、镍等金属及其化合物在科学研究和工业生产中应用十分广泛。回答下列问题:
(1)铁、钴、镍的基态原子核外未成对电子数最多的是________。
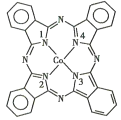
(2)酞菁钴分子的结构简式如图所示,中心离子为钴离子,酞钴分子中与钴离子通过配位键结合的氮原子的编号是_______(填1、2、3、4),三种非金属原子的电负性由大到小的顺序为____(用相应的元素符号表示);氮原子的杂化轨道类型为____。
(3)Fe(CO)x,常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x,晶体属于_____(填晶体类型),若配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=_______。
(4)NiO、FeO的晶体结构类型与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiO____FeO(填“>”“<”或“=”),原因是____________。
(5)NiAs的晶胞结构如图所示:
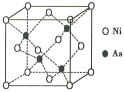
①镍离子的配位数为__________。
②若阿伏加德罗常数的值为NA,晶体密度为pg·cm-3,则该晶胞中最近的Ni2+之间的距离为______cm。(写出计算表达式)
【答案】 铁 2、4 N>C>H sp2;sp3 分子晶体 5 > 相同电荷的离子半径越小,晶格能越大 4 ![]()
【解析】分析:根据铁、钴、镍的基态原子核外电子排布式判断未成对电子数;
(2)①酞菁钴中三种非金属原子为C、N、H,同周期自左而右电负性增大,非金属性越强电负性越大;分子中C原子均形成3个σ键,没有孤对电子,杂化轨道数目为3;
②含有孤对电子的N原子与Co通过配位键结合,形成配位键后形成4对共用电子对,形成3对共用电子对的N原子形成普通的共价键
(3)分子晶体的熔沸点较低;配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,据此判断x值;
(4)NiO、FeO的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,熔点越高;
(5)①砷离子和镍离子的配位数相等,根据砷离子周围有4个镍离子判断砷离子的配位数,再判断镍离子的配位数;
②晶胞中含有的镍离子为4个和4个砷离子,计算晶胞的边长,晶胞中最近的Ni2+之间的距离为面对角线的一半。
详解:(1) 铁、钴、镍的基态原子核外电子排布式分别为1s22s22p63s23p63d64s2、1s22s22p63s23p63d74s2、1s22s22p63s23p63d84s2,未成对电子数分别为4、3、2,最多的是铁,故答案为:铁;
(2)含有孤对电子的N原子与Co通过配位键结合,形成配位键后形成4对共用电子对,形成3对共用电子对的N原子形成普通的共价键,1号、3号N原子形成3对共用电子对为普通共价键,2号、4号N原子形成4对共用电子对,与Co通过配位键结合;酞菁钴中三种非金属原子为C、N、H,同周期自左而右电负性增大,非金属性越强电负性越大,故电负性N>C>H;分子中N原子有2种,一种形成3个σ键,没有孤对电子,杂化轨道数目为3,N原子的杂化轨道类型为 sp2,一种形成3个σ键,含有1个孤对电子,杂化轨道数目为4,N原子的杂化轨道类型为 sp3,故答案为:2,4;N>C>H;sp2、sp3;
(3)分子晶体的熔沸点较低,根据题给信息知,该物质的熔沸点较低,所以为分子晶体,配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2x=18,x=5,故答案为:分子晶体;5;
(4)NiO、FeO的晶体结构类型均与氯化钠的相同,说明二者都是离子晶体,离子晶体的熔点与离子键的强弱有关,离子所带电荷数越多,离子半径越小,离子键越强,晶格能越大,熔点越高,由于Ni2+的离子半径小于Fe2+的离子半径,属于熔点是NiO>FeO,故答案为:>;相同电荷的离子半径越小,晶格能越大,熔点越高;
(5)①根据图示,砷离子周围有4个镍离子,构成正四面体,配位数为4,晶体中Ni和As的数目比为1:1,因此镍离子周围也有4个砷离子,配位数为4,故答案为:4;
②根据图示,晶胞中含有的镍离子为4个,砷离子数目为8×![]() +6×
+6×![]() =4,晶胞的质量=
=4,晶胞的质量=![]() =
=![]() g,晶体密度为pg·cm-3,则晶胞的边长=
g,晶体密度为pg·cm-3,则晶胞的边长=![]() cm,晶胞中最近的Ni2+之间的距离为面对角线的一半,为
cm,晶胞中最近的Ni2+之间的距离为面对角线的一半,为![]() cm,故答案为:
cm,故答案为:![]() 。
。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案【题目】某同学做元素性质递变规律实验时,设计了一套实验方案,记录了有关实验现象。
实验步骤 | 实验现象 |
① 将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
②将一小块金属钠放入滴有酚酞溶液的冷水中 | B.有气体产生,溶液变成浅红色 |
③将镁条投入稀盐酸中 | C.反应不十分剧烈;产生无色气体 |
④将铝条投入稀盐酸中 | D.剧烈反应,迅速产生大量无色气体 |
请帮助该同学整理并完成实验报告。
(1)实验目的:研究_________________元素性质递变规律。
(2)实验内容:(填写与实验步骤对应的实验现象的编号)
实验内容 | ① | ② | ③ | ④ |
实验现象(填A~D) | _________ | ______ | _______ | ___________ |
(3)写出实验①\②对应化学方程式
实验① ______________________________________________________________________,
实验②_______________________________________________________________________。
(4)实验结论:______________________________________________。