题目内容
【题目】现有3.2g某气体(分子式:RH4),摩尔质量为16 g·mol-1,则:
(1)R的相对原子质量为____________
(2)该气体所含分子数为___________________NA。
(3)该气体在标准状况下的体积约为___________________L。
(4)其中氢原子数目与___________ gNH3中的氢原子数目相同
【答案】12 1.204×1023 4.48L 4.53g
【解析】
(1)-(3)根据n=![]() =
=![]() 、ρ=
、ρ=![]() 计算;
计算;
(4) 计算RH4的物质的量,结合H原子数目相等计算NH3的物质的量,再根据m=nM计算NH3的总质量。
(1)①物质的摩尔质量数值上等于相对分子质量,因RH4的摩尔质量为16 g·mol-1,则RH4的相对分子质量为16;故R的相对原子质量为12;
②依据n=![]() =
=![]() =0.2mol;该气体所含分子数= nNA=0.2mol×NA=0.2NA=1.204×1023;
=0.2mol;该气体所含分子数= nNA=0.2mol×NA=0.2NA=1.204×1023;
③该气体在标准状况下的体积= n×22.4L/mol= 0.2mol×22.4L/ mol = 4.48L;
(2) RH4为甲烷,0.2mol甲烷中氢原子的物质的量为0.2mol×4=0.8mol,与甲烷中氢原子数目相同的氨气的物质的量为![]() ,其质量为
,其质量为![]() ×17g/mol=4.53g。
×17g/mol=4.53g。

【题目】异丁烷脱氢制异丁烯反应为:![]()
副反应为裂解反应:![]()
![]() 已知:
已知:
化学键 | | | | |
键能 | 412 | 348 | 612 | 436 |
试计算异丁烷脱氢反应的![]() ______
______![]()
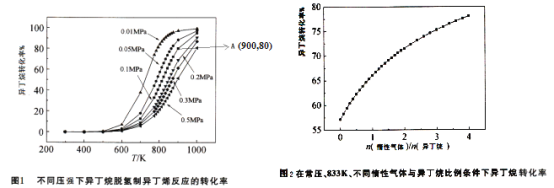
![]() 不同压强条件下异丁烷脱氢反应的转化率如图1所示。下列说法不正确的是______。
不同压强条件下异丁烷脱氢反应的转化率如图1所示。下列说法不正确的是______。
A.主反应和副反应均在低温条件下自发
B.开发高选择性的催化剂,有效抑制副反应的发生,可提高异丁烯的选择性
C.由图1可知,![]() 范围内,温度不变,压强增大,异丁烷脱氢反应的转化率降低
范围内,温度不变,压强增大,异丁烷脱氢反应的转化率降低
D.选择合适的温度,使催化剂的活性最大,有利于提高异丁烷的平衡转化率
![]() 平衡常数的表达式中平衡浓度可以用平衡时各气体的分压代替
平衡常数的表达式中平衡浓度可以用平衡时各气体的分压代替![]() 分压
分压![]() 物质的量分数
物质的量分数![]() 总压强
总压强![]() 。图1中,A点状态下的异丁烷脱氢反应的平衡常数
。图1中,A点状态下的异丁烷脱氢反应的平衡常数![]() ______
______![]() 保留两位有效数字
保留两位有效数字![]() 。
。
![]() 常压、833K条件下,异丁烷脱氢制异丁烯的转化率随着惰性气体与异丁烷比例的变化情况如图2,请解释随着惰性气体与异丁烷比例的增加,异丁烷转化率逐渐增加的原因:______。
常压、833K条件下,异丁烷脱氢制异丁烯的转化率随着惰性气体与异丁烷比例的变化情况如图2,请解释随着惰性气体与异丁烷比例的增加,异丁烷转化率逐渐增加的原因:______。
![]() 请在图2中画出温度为
请在图2中画出温度为![]() ,其他条件不变时,异丁烷转化率图象。
,其他条件不变时,异丁烷转化率图象。
![]() 科学家发现,以
科学家发现,以![]() 和
和![]() 为原料,熔融
为原料,熔融![]() 为电解质,纳米
为电解质,纳米![]() 作催化剂,在
作催化剂,在![]() 和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行,请补充完整。电极反应式:______和
和常压下可实现电化学合成氨。阴极区发生的变化可视为按两步进行,请补充完整。电极反应式:______和![]() 。
。