题目内容
分解水制氢气的工业制法之一是硫——碘循环,主要涉及下列反应:
I SO2+2H2O+I2→H2SO4+2HI
II 2HI H2+I2
H2+I2
III 2H2SO4 → 2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是_________
a.反应III易在常温下进行 b.反应I中SO2还原性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2的同时产生1molH2
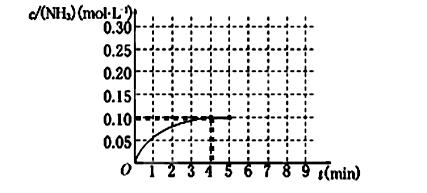
(2)一定温度下,向2L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示。

0—2min内的平均反应速率v(HI)= _________ 。该温度下,反应2HI(g) H2(g)+I2(g)的平衡常数表达式为K=_______________________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_________是原来的2倍。
H2(g)+I2(g)的平衡常数表达式为K=_______________________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_________是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)SO2在一定条件下可氧化生成SO3,其主反应为:2SO2 (g) + O2(g) 2SO3(g) + Q,若此反应起始的物质的量相同,则下列关系图正确的是_________ (填序号)
2SO3(g) + Q,若此反应起始的物质的量相同,则下列关系图正确的是_________ (填序号)

实际工业生产使用的条件是:常压、____________________________________选择该条件的原因是__________________。
(4)实际生产用氨水吸收SO2生成亚硫酸的铵盐。现取a克该铵盐,若将其中的SO2全部反应出来,应加入18.4 mol/L的硫酸溶液的体积范围为______________。
I SO2+2H2O+I2→H2SO4+2HI
II 2HI
 H2+I2
H2+I2III 2H2SO4 → 2SO2+O2+2H2O
(1)分析上述反应,下列判断正确的是_________
a.反应III易在常温下进行 b.反应I中SO2还原性比HI强
c.循环过程中需补充H2O d.循环过程中产生1molO2的同时产生1molH2
(2)一定温度下,向2L密闭容器中加入1molHI(g),发生反应II,H2物质的量随时间的变化如图所示。

0—2min内的平均反应速率v(HI)= _________ 。该温度下,反应2HI(g)
 H2(g)+I2(g)的平衡常数表达式为K=_______________________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_________是原来的2倍。
H2(g)+I2(g)的平衡常数表达式为K=_______________________。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则_________是原来的2倍。a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
(3)SO2在一定条件下可氧化生成SO3,其主反应为:2SO2 (g) + O2(g)
 2SO3(g) + Q,若此反应起始的物质的量相同,则下列关系图正确的是_________ (填序号)
2SO3(g) + Q,若此反应起始的物质的量相同,则下列关系图正确的是_________ (填序号)
实际工业生产使用的条件是:常压、____________________________________选择该条件的原因是__________________。
(4)实际生产用氨水吸收SO2生成亚硫酸的铵盐。现取a克该铵盐,若将其中的SO2全部反应出来,应加入18.4 mol/L的硫酸溶液的体积范围为______________。
(1)bc(2分)
(2)0.05mol·L-1·min-1; ;b (各1分)
;b (各1分)
(3)bd;五氧化二钒、500℃;加快反应速度。(共5分)
(4)a/116×18.4~a/198×18.4 (2分)
(2)0.05mol·L-1·min-1;
 ;b (各1分)
;b (各1分)(3)bd;五氧化二钒、500℃;加快反应速度。(共5分)
(4)a/116×18.4~a/198×18.4 (2分)
试题分析:(1)a.反应III2H2SO4 → 2SO2+O2+2H2O是分解反应,要在高温下进行。b.根据还原剂的还原性强于还原产物的还原性,故反应I中SO2还原性比HI强,正确。c.水在循环过程中始终消耗,故需补充H2O,正确。d.根据电子守恒,循环过程中产生1molO2转移4mol电子,同时产生2molH2,错误。故选bc。
(2)根据平均反应速率v(HI)="2v(H2)=2*0.1/(2*2" )= 0.05mol·L-1·min-。该温度下,反应2HI(g)
 H2(g)+I2(g)的平衡常数表达式为K=
H2(g)+I2(g)的平衡常数表达式为K=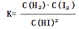 。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,根据反应前后体积不变这个特点可知与原平衡是等效平衡,则HI的平衡浓度是原来的2倍,而平衡常数只与温度有关,温度不变,平衡常数也不变,平衡时H2的体积分数相同。
。相同温度下,若开始加入HI(g)的物质的量是原来的2倍,根据反应前后体积不变这个特点可知与原平衡是等效平衡,则HI的平衡浓度是原来的2倍,而平衡常数只与温度有关,温度不变,平衡常数也不变,平衡时H2的体积分数相同。(3)根据反应2SO2 (g) + O2(g)
 2SO3(g) + Q的特点,正反应体积减小,放热反应,故关系图正确的是bd。实际工业生产还要根据设备的成本,反应速率及催化剂的适宜温度综合考虑故使用的条件是:常压、五氧化二钒、500℃;选择该条件的原因是加快反应速度。
2SO3(g) + Q的特点,正反应体积减小,放热反应,故关系图正确的是bd。实际工业生产还要根据设备的成本,反应速率及催化剂的适宜温度综合考虑故使用的条件是:常压、五氧化二钒、500℃;选择该条件的原因是加快反应速度。(4)亚硫酸的铵盐正盐和酸式盐两种情况。若a克分别是两种铵盐时,应加入18.4 mol/L的硫酸溶液的体积设为v,则
(NH4)2SO3 -----H2SO4 2NH4HSO3----H2SO4
a/116 a/116 a/99 a/198
v=a/116×18.4 v=a/198×18.4,应加入18.4 mol/L的硫酸溶液的体积范围为a/198×18.4----a/116×18.4。

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
 C(g)+D(g),其中a为正整数。反应过程中,当其他条件不
C(g)+D(g),其中a为正整数。反应过程中,当其他条件不
 2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表:
2H2(g)+O2(g) ΔH=+484 kJ·mol-1,不同时间产生O2的物质的量见下表: 2C(g)+xD(g)DH<0 ;5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol·(L·min)-1.下列说法中正确的是
2C(g)+xD(g)DH<0 ;5min达平衡,此时生成2molC,测得D的平均反应速率为0.1mol·(L·min)-1.下列说法中正确的是 CO(NH2)2(s)+H2O(g)
CO(NH2)2(s)+H2O(g)  2C(气);△H<0 ,经 2 s(秒)后测得 C 的浓度为0.6 mol·L-1 ,现有下列几种说法:
2C(气);△H<0 ,经 2 s(秒)后测得 C 的浓度为0.6 mol·L-1 ,现有下列几种说法: 2C(g)(正反应吸热),下列图象正确的是
2C(g)(正反应吸热),下列图象正确的是


 经一段时间后达到平衡。反应过程中测定的部分数据见下表:
经一段时间后达到平衡。反应过程中测定的部分数据见下表:
 ,则反应的
,则反应的
 、
、 和
和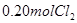 ,达到平衡前v(正)>v(逆)
,达到平衡前v(正)>v(逆) 、
、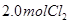 ,达到平衡时,
,达到平衡时, 的转化率小于80%
的转化率小于80%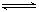 2NH3(g) ΔH<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) ΔH<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题: