题目内容
【题目】为了除去KCl固体中少量的MgCl2、MgSO4,可选用Ba(OH)2、盐酸和K2CO3三种 试剂,按如下步骤操作:
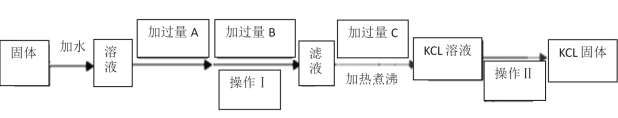
(1)图中三种试剂分别为:A__________________、 B__________________、 C___________________。
(2)加入过量A的目的是______________________________________________________________________;
加入过量B的目的是______________________________________________________________________;
加热煮沸的目的是______________________________________________________________________;
(3)操作Ⅱ的名称是______________________________。
(4)检验得到的KCl中不含有SO42-的操作________________________________________
【答案】Ba(OH)2K2CO3盐酸除尽Mg2+和SO42-除尽过量的Ba2+使过量的HCl挥发蒸发取KCl固体少许于试管中,滴加蒸馏水溶解,先滴加稀盐酸再滴加氯化钡溶液,若不产生白色沉淀,则证明不含有硫酸根离子
【解析】
为了除去MgCl2、MgSO4应加入过量的Ba(OH)2,充分反应后生成Mg(OH)2沉淀和BaSO4沉淀,KCl中仍含有BaCl2和过量的Ba(OH)2,再向体系中加入过量的K2CO3除去BaCl2和过量的Ba(OH)2,充分反应后过滤,所得滤液中含有KCl、KOH和过量的K2CO3;最后向滤液中加入过量的盐酸除去KOH和过量的K2CO3,由于盐酸具有挥发性,将溶液加热煮沸使过量的HCl挥发获得KCl溶液,将KCl溶液蒸发获得KCl固体。根据以上分析回答(1)~(3)。用稀盐酸和BaCl2溶液检验SO42-。
为了除去MgCl2、MgSO4应加入过量的Ba(OH)2,充分反应后生成Mg(OH)2沉淀和BaSO4沉淀,KCl中仍含有BaCl2和过量的Ba(OH)2,再向体系中加入过量的K2CO3除去BaCl2和过量的Ba(OH)2,充分反应后过滤,所得滤液中含有KCl、KOH和过量的K2CO3;最后向滤液中加入过量的盐酸除去KOH和过量的K2CO3,由于盐酸具有挥发性,将溶液加热煮沸使过量的HCl挥发获得KCl溶液,将KCl溶液蒸发获得KCl固体。
(1)根据上述分析,图中三种试剂,A为Ba(OH)2,B为K2CO3,C为盐酸。
(2)加入过量A的目的是除尽Mg2+和SO42-,加入A发生的反应为MgCl2+Ba(OH)2=Mg(OH)2↓+BaCl2、MgSO4+Ba(OH)2=Mg(OH)2↓+BaSO4↓。加入过量B的目的是除尽过量的Ba2+,发生的反应为BaCl2+K2CO3=BaCO3↓+2KCl、Ba(OH)2+K2CO3=BaCO3↓+2KOH。向滤液中加入过量的盐酸除去KOH和过量的K2CO3,由于盐酸具有挥发性,加热煮沸的目的是使过量的HCl挥发。
(3)从KCl溶液中获得KCl固体的操作为蒸发,操作II的名称是蒸发。
(4)用稀盐酸和BaCl2溶液检验SO42-。检验得到的KCl中不含SO42-的操作:取KCl固体少许于试管中,滴加蒸馏水溶解,先滴加稀盐酸再滴加氯化钡溶液,若不产生白色沉淀,则证明不含有SO42-。

【题目】【加试题】甲醇水蒸气重整制氢(SRM)是用于驱动电动汽车的质子交换膜燃料电池的理想氢源,当 前研究主要集中在提高催化剂活性和降低尾气中CO含量,以免使燃料电池Pt电极中毒。重整过程发生的反应如下:
反应I CH3OH(g)+H2O(g) ![]() CO2(g)+3H2(g) ΔH1
CO2(g)+3H2(g) ΔH1
反应Ⅱ CH3OH(g) ![]() CO(g)+2H2(g) ΔH2
CO(g)+2H2(g) ΔH2
反应Ⅲ.CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH3
CO2(g)+H2(g) ΔH3
其对应的平衡常数分别为K1、K2、K3,其中K2、K3随温度变化如下表所示:
125℃ | 225℃ | 325℃ | |
K2 | 0.5535 | 185.8 | 9939.5 |
K3 | 1577 | 137.5 | 28.14 |
请回答:
(1)反应Ⅱ能够自发进行的条件_______ (填 “低温”、“高温”或“任何温度”), ΔH1____ΔH3 (填 “>”、“<”或 “=” )。
(2)相同条件下,甲醇水蒸气重整制氢较甲醇直接分解制氢(反应Ⅱ)的先进之处在于_________。
(3)在常压、CaO催化下,CH3OH和H2O混和气体(体积比1∶1.2,总物质的量2.2mol)进行反应,tl时刻测得 CH3OH转化率及CO、CO2选择性随温度变化情况分别如图所示(CO、CO2的选择性:转化的CH3OH中生成CO、CO2的百分比)。
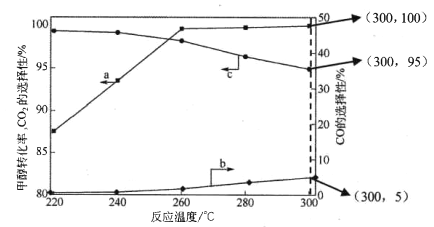
注:曲线a表示CH3OH的转化率,曲线b表示CO的选择性,曲线c表示 CO2的选择性
① 下列说法不正确的是_____。
A.反应适宜温度为300℃
B.工业生产通 常在负压条件下进行甲醇水蒸气重整
C.己知 CaO催化剂具有更高催化活性,可提高甲醇平衡转化率
D.添加CaO的复合催化剂可提高氢气产率
② 260℃ 时H2物质的量随时间的变化曲线如图所示。画出300℃时至t1时刻H2物质的量随时间的变化曲线_____。
(4)副产物CO2可以在酸性水溶液中电解生成甲酸,生成甲酸的电极反应式是_________。