题目内容
【题目】向100mL 1.0molL﹣1的AlCl3溶液中逐滴加入0.5molL﹣1的NaOH溶液至过量,生成沉淀的物质的量与加入NaOH的量的理论曲线图正确的是( )
A.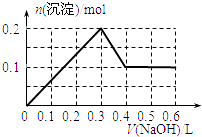
B.
C.
D.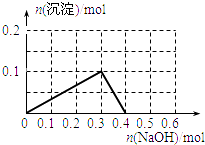
【答案】D
【解析】解:向氯化铝溶液中加入氢氧化钠溶液发生的化学反应为:AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O,当铝离子恰好和氢氧化钠完全反应生成氢氧化铝时,沉淀的物质的量最大,当氢氧化铝完全转化为偏铝酸钠时,沉淀完全消失;
根据方程式AlCl3+3NaOH=Al(OH)3↓+3NaCl、Al(OH)3+NaOH=NaAlO2+2H2O知,铝离子完全转化为沉淀和沉淀完全消失需要氢氧化钠的物质的量之比为3:1,n(AlCl3)=1.0mol/L×0.1L=0.1mol,完全沉淀时需要氢氧化钠溶液的体积= ![]() =600mL,根据原子守恒得n(Al(OH)3)=n(AlCl3)=0.1mol,
=600mL,根据原子守恒得n(Al(OH)3)=n(AlCl3)=0.1mol,
故选D.

【题目】实验室用少量的溴水和足量的乙醇制备1,2﹣二溴乙烷的装置如下图所示: 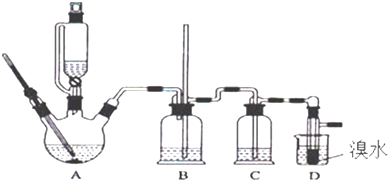
有关数据列表如下:
乙醇 | 1,2﹣二溴乙烷 | 醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | ﹣l30 | 9 | ﹣1l6 |
回答下列问题:
(1)烧瓶A中发生的主要的反应方程式 .
(2)装置B的作用是 .
(3)在装置C中应加入(填字母). a.水 b.浓硫酸 c.饱和碳酸氢钠溶液 d.氢氧化钠溶液
(4)若产物中有少量未反应的Br2 , 最好用(填字母)洗涤除去. a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇 e.Na2SO3溶液
(5)若产物中有少量副产物乙醚,可用的方法除去.
(6)反应过程中应用冷水冷却装置D,但又不能过度冷却(如用冰水),其原因是 .
(7)判断该制备反应已经结束的最简单方法是 .