题目内容
【题目】下表为元素周期表的一部分,请参照元素①一⑧在表中的位置,用化学用语回答下列问题:
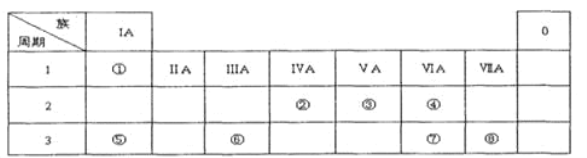
Ⅰ.(1)请画出元素⑧的阴离子结构示意图_________。
(2)④、⑤、⑦的原子半径由小到大的顺序为________。
(3)⑤和⑥的最高价氧化物对应水化物的碱性强弱为_______>______。
(4)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为__________。
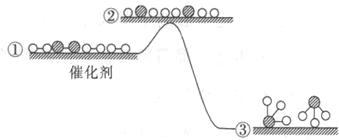
Ⅱ.由表中①一⑧中的一种或几种元素形成的常见物质A、B、C可发生以下反应(副产物已略去),试回答:
![]()
(1)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,C溶液中金属离子与氢氧化钠溶液反应的产物在空气中发生颜色变化的方程式________;又知在酸性溶液中该金属离子能被双氧水氧化,写出该反应的离子方程式_________________。
(2)若A、B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为______,写出A与C两溶液反应的离子方程式___________。
【答案】) Na>S>O NaOH Al(OH)3
Na>S>O NaOH Al(OH)3 ![]() 4Fe(OH)2+O2+2H2O=4Fe(OH)3 H2O2+2Fe2++2H+=2Fe3++2H2O Al(OH)3 Al3++3AlO2-+6H2O=4Al(OH)3↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3 H2O2+2Fe2++2H+=2Fe3++2H2O Al(OH)3 Al3++3AlO2-+6H2O=4Al(OH)3↓
【解析】
由表可推知,①~⑧分别为H、C、N、O、Na、Al、S、Cl;
Ⅰ.(1)元素⑧的阴离子为Cl-,与原子结构示意图相比,离子结构示意图的最外层比原子多1个电子;
(2)比较④、⑤、⑦的原子半径时,看先电子层数,电子层数多,半径大;若电子层数相同,再看最外层电子数,最外层电子数越多,半径越小;
(3)比较⑤和⑥的最高价氧化物对应水化物的碱性时,可比较二者的金属性;
(4)④、⑤两种元素的原子按1:1组成的常见化合物为Na2O2;
Ⅱ.(1)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则C中含有Cl-,C溶液中金属离子与氢氧化钠溶液反应的产物在空气中发生颜色变化,则C中含有Fe2+,从而确定X为Fe。发生颜色变化时,Fe(OH)2与O2、H2O反应转化为Fe(OH)3;在酸性溶液中该金属离子能被双氧水氧化,发生的反应为Fe2+被H2O2氧化为Fe3+;
(2)若A、B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则A、B、C三种物质中均含有铝,从而得出A为AlCl3、B为Al(OH)3、C为NaAlO2。
Ⅰ.(1)元素⑧的阴离子为Cl-,离子结构示意图为 ;
;
(2)比较④、⑤、⑦的原子半径时,看先电子层数,电子层数多,半径大;若电子层数相同,再看最外层电子数,最外层电子数越多,半径越小。从而得出Na>S>O;
(3)金属性Na>Al,则⑤和⑥的最高价氧化物对应水化物的碱性,NaOH>Al(OH)3;
(4)④、⑤两种元素的原子按1:1组成的常见化合物为Na2O2,其电子式为![]() ;
;
Ⅱ.(1)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,则C中含有Cl-,C溶液中金属离子与氢氧化钠溶液反应的产物在空气中发生颜色变化,则C中含有Fe2+,从而确定X为Fe。发生颜色变化时,Fe(OH)2与O2、H2O反应转化为Fe(OH)3,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3;在酸性溶液中该金属离子能被双氧水氧化,发生的反应为H2O2+2Fe2++2H+=2Fe3++2H2O;
(2)若A、B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则A、B、C三种物质中均含有铝,从而得出A为AlCl3、B为Al(OH)3、C为NaAlO2。则B的化学式为Al(OH)3,A与C两溶液反应的离子方程式Al3++3AlO2-+6H2O=4Al(OH)3↓。

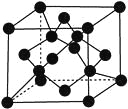
【题目】原子序数依次增大的X、Y、Z、G、Q、R、T七种元素,核电荷数均小于36。已知X的一种1∶2型氢化物分子中既有σ键又有π键,且所有原子共平面;Z的L层上有2个未成对电子;Q原子的s能级与p能级电子数相等;R单质是制造各种计算机、微电子产品的核心材料;T处于周期表的ds区,原子中只有一个未成对电子。
(1)Y原子核外共有________种不同运动状态的电子,基态T原子有________种不同能级的电子。
(2)X、Y、Z的第一电离能由小到大的顺序为_______________(用元素符号表示)。
(3)由X、Y、Z形成的离子ZXY-与XZ2互为等电子体,则ZXY-中X原子的杂化轨道类型为_______________________。
(4)Z与R能形成化合物甲,1 mol甲中含________mol化学键,甲与氢氟酸反应,生成物的分子空间构型分别为___________________。
(5)G、Q、R氟化物的熔点如下表,造成熔点差异的原因为_________________。
氟化物 | G的氟化物 | Q的氟化物 | R的氟化物 |
熔点/K | 993 | 1539 | 183 |
(6)向T的硫酸盐溶液中逐滴加入Y的氢化物的水溶液至过量,反应的离子方程式为___________,
(7)X单质的晶胞如图所示,一个X晶胞中有________个X原子。