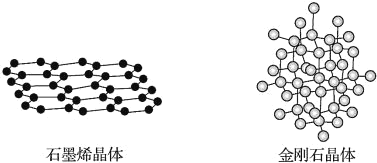
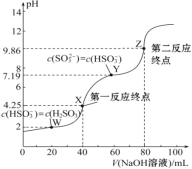
题目内容
【题目】如图所示,装置(Ⅰ)是一种可充电电池,装置(Ⅱ)为惰性电极的电解池。下列说法错误的是
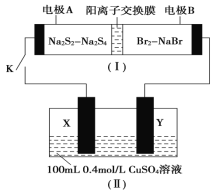
A.闭合开关K时,电极B为正极,且电极反应式为Br2+2e-===2Br-
B.装置(Ⅰ)充电时,Na+从左到右通过阳离子交换膜
C.装置(Ⅰ)放电时,总反应为2Na2S2+Br2===Na2S4+2NaBr
D.该装置电路中有0.1mole-通过时,电极X理论上析出2.56gCu
【答案】B
【解析】
装置(Ⅰ)是一种可充电电池,电池充、放电的化学反应方程式为2Na2S2+Br2![]() Na2S4+2NaBr,负极反应为2Na2S2-2e-=2Na++Na2S4,正极反应为Br2+2e-=2Br-,则A为原电池的负极,B为原电池的正极,Y极为电解池的阳极,电极反应为4OH--4e-=O2↑+2H2O,X极为电解池的阴极,电极反应为Cu2++2e-=Cu,若Cu2+反应完全后,电极反应为2H2O+2e-=H2↑+2OH-,以此解答。
Na2S4+2NaBr,负极反应为2Na2S2-2e-=2Na++Na2S4,正极反应为Br2+2e-=2Br-,则A为原电池的负极,B为原电池的正极,Y极为电解池的阳极,电极反应为4OH--4e-=O2↑+2H2O,X极为电解池的阴极,电极反应为Cu2++2e-=Cu,若Cu2+反应完全后,电极反应为2H2O+2e-=H2↑+2OH-,以此解答。
A.由上述分析可知,B为原电池的正极,正极反应为Br2+2e-=2Br-,故A不符合题意;
B.装置(Ⅰ)充电时,电极A为阴极,电极B为阳极,则Na+从阳极移向阴极,即从右侧移向左侧,故B符合题意;
C.由上述分析可知,装置(Ⅰ)放电时,总反应为:2Na2S2+Br2=Na2S4+2NaBr,故C不符合题意;
D.X极为电解池的阴极,电极反应为Cu2++2e-=Cu,电路中有0.1mole-通过时,溶液中所含Cu2+的物质的量为0.1L×0.4mol/L=0.04mol,Cu2+完全反应得到0.08mol电子,即后续发生2H2O+2e-=H2↑+2OH-,因此溶液中Cu2+全部生成Cu,其质量为0.04mol×64g/mol=2.56g,故D不符合题意;
故答案为:B。

 名校课堂系列答案
名校课堂系列答案