题目内容
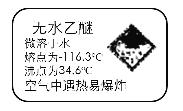
【题目】如图所示标出的是元素周期表的一部分元素,据图回答下列问题。
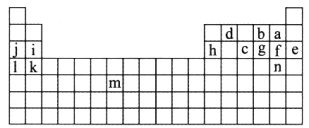
(1)图中用字母标出的14种元素中,化学性质最不活泼的是________(用元素符号表示,下同),金属性最强的是________,非金属性最强的是________,常温下单质为液态的非金属元素是________________,属于过渡元素的是________(本空用图中字母表示)。
(2)b、f、c气态氢化物的化学式分别为________、________、________,其中热稳定性最弱的是______。
(3)图中第三周期元素中原子半径最小的是________(稀有气体元素除外)。
【答案】Ar K F Br m H2O HCl PH3 PH3 Cl
【解析】
(1)根据元素在周期表中的位置可判断E是稀有气体元素Ar,化学性质最不活泼。金属性最强的元素位于第IA的l,l是K。非金属性最强的是位于第 ⅦA 的a,即F。常温下单质为液态的非金属元素是Br,即是n。周期表中第3列至第12列共10列元素属于过渡元素,所以属于过渡元素的是m;
(2)b、f、c分别是O、Cl、P,最低价分别是-1价、-1价和-3价,因此气态氢化物的化学式分别为H2O、HCl、PH3。非金属性越强,氢化物的稳定性越强,三种元素的非金属性强弱顺序为O>Cl>P,所以PH3 的稳定性最差;
(3)同周期自左向右原子半径逐渐减小,所以第三周期中原子半径最小的是Cl。

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目