题目内容
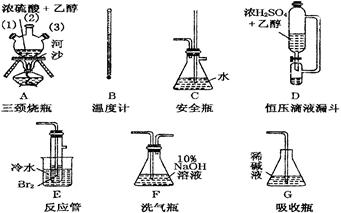
制备氮化镁的装置示意图如下:
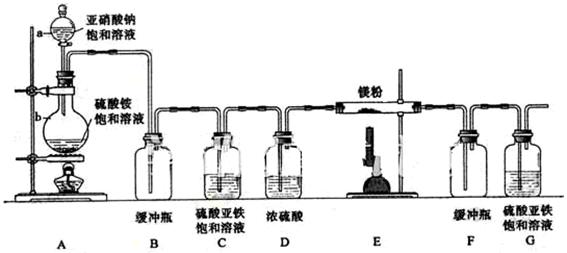
回答下列问题:
(1)检查装置气密性的方法是 ,
a的名称是 ,b的名称是 ;
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式 ;
(3)C的作用是 ,D的作用是 ,是否可以把C和D的位置对调并说明理由 ;
(4)写出E中发生反应的化学方程式 ;
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现
象 。

回答下列问题:
(1)检查装置气密性的方法是 ,
a的名称是 ,b的名称是 ;
(2)写出NaNO2和(NH4)2SO4反应制备氮气的化学方程式 ;
(3)C的作用是 ,D的作用是 ,是否可以把C和D的位置对调并说明理由 ;
(4)写出E中发生反应的化学方程式 ;
(5)请用化学方法确定是否有氮化镁生成,并检验是否含有未反应的镁,写出实验操作及现
象 。
(1)关闭分液漏斗的活塞,微热b,这时G中有气泡冒出,停止加热冷却后,G中插在溶液里的玻璃管形成一段水柱,则气密性良好(2分) 分液漏斗(1分) 圆底烧瓶(1分)
(2)2NaNO2+(NH4)2SO4
 2N2↑+Na2SO4+4H2O(2分)
2N2↑+Na2SO4+4H2O(2分)(3)除去氧气(及氮氧化物)(1分) 除去水蒸气 (1分) 不能,对调后无法除去水蒸气(1分)
(4)N2+3Mg
 Mg3N2(2分)
Mg3N2(2分)(5)取少量产物于试管中,加少量蒸馏水,试管底部有沉淀生成,可闻到刺激性氨味(把湿润的红色石蕊试纸放在管口,试纸变蓝),证明产物中含有氮化镁;弃去上清夜,加盐酸,若观察到有气泡产生,则证明产物中含有未反应的镁。(4分)
解此类物质制备题,首先要明确实验目的、实验原理及所制备物质的性质;并结合装置图综合分析得出结论。该实验目的是制备Mg3N2,其原理是:N2+3Mg Mg3N2,从图看此反应在装置E中发生。由装置A及药品可知,A是N2的发生装置,其装置类型为:液+液
Mg3N2,从图看此反应在装置E中发生。由装置A及药品可知,A是N2的发生装置,其装置类型为:液+液 制气型;所以(1)中气密性检验方法是最常规的方法--微热法,其仪器名称:a是分液漏斗,b是圆底烧瓶;
制气型;所以(1)中气密性检验方法是最常规的方法--微热法,其仪器名称:a是分液漏斗,b是圆底烧瓶;
(2)制N2的反应,其原理是NH4+与NO2—间的归中反应,只要基础扎实,很容易写出化学方程式。
(3)制得的N2常混有O2、氮氧化物、水蒸气,它们都会对Mg3N2的生成带来干扰,O2和氮氧化物会氧化Mg粉使制得的Mg3N2不纯,水蒸气会使Mg3N2水解而生成Mg(OH)2 ;所以,C中利用Fe2+的还原性可除去O2及氮氧化物; D中用浓硫酸可除水蒸气。
(4)Mg3N2及Mg的检验是利用了如下反应: Mg3N2+6H2O= 3Mg(OH)2↓+2 NH3↑;Mg+2HCl=MgCl2+H2↑从而达到检验产物的目的。
【考点定位】本题是对物质制备实验方案设计的综合考查;围绕气密性检验、仪器名称、物质的制备原理、净化和产物的检验等问题思考。其解题的关键是运用有关的化学知识和技能,对实验所用的仪器、装置及作用进行科学而合理的综合分析。难度适中。
 Mg3N2,从图看此反应在装置E中发生。由装置A及药品可知,A是N2的发生装置,其装置类型为:液+液
Mg3N2,从图看此反应在装置E中发生。由装置A及药品可知,A是N2的发生装置,其装置类型为:液+液 制气型;所以(1)中气密性检验方法是最常规的方法--微热法,其仪器名称:a是分液漏斗,b是圆底烧瓶;
制气型;所以(1)中气密性检验方法是最常规的方法--微热法,其仪器名称:a是分液漏斗,b是圆底烧瓶;(2)制N2的反应,其原理是NH4+与NO2—间的归中反应,只要基础扎实,很容易写出化学方程式。
(3)制得的N2常混有O2、氮氧化物、水蒸气,它们都会对Mg3N2的生成带来干扰,O2和氮氧化物会氧化Mg粉使制得的Mg3N2不纯,水蒸气会使Mg3N2水解而生成Mg(OH)2 ;所以,C中利用Fe2+的还原性可除去O2及氮氧化物; D中用浓硫酸可除水蒸气。
(4)Mg3N2及Mg的检验是利用了如下反应: Mg3N2+6H2O= 3Mg(OH)2↓+2 NH3↑;Mg+2HCl=MgCl2+H2↑从而达到检验产物的目的。
【考点定位】本题是对物质制备实验方案设计的综合考查;围绕气密性检验、仪器名称、物质的制备原理、净化和产物的检验等问题思考。其解题的关键是运用有关的化学知识和技能,对实验所用的仪器、装置及作用进行科学而合理的综合分析。难度适中。

练习册系列答案
相关题目
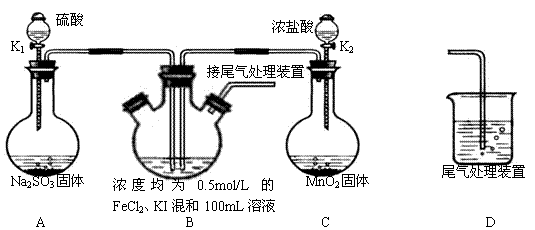
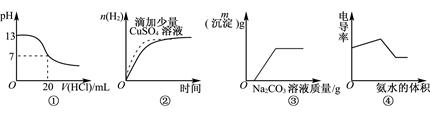
 ②
② ③
③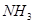 ④
④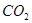 ⑤
⑤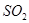 ⑥
⑥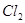 ,其中不能用排水法收集的气体是( )
,其中不能用排水法收集的气体是( )