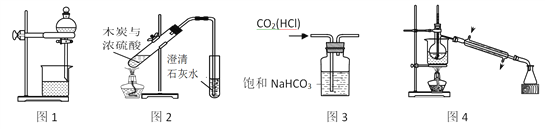
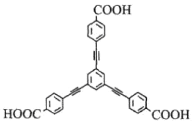
题目内容
【题目】25 ℃时,向25 mL 0.1 mol·L-1 NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,滴定曲线如图所示,下列说法正确的是
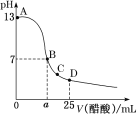
A. 在A、B间任一点的溶液中一定都有:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B. 用含a的代数式表示CH3COOH的电离常数K=2.5×10—7/(0.2a-2.5)
C. C点对应的溶液中,水电离出的H+浓度大于10-7 mol·L-1
D. D点对应的溶液中,存在如下关系:c(CH3COO-)-c(CH3COOH)=2c(H+)-c(OH-)
【答案】B
【解析】
A.A、B间任一点,溶液显碱性,溶质为醋酸钠、NaOH或恰好生成醋酸钠;
B.根据CH3COOH的电离常数K=c(CH3COO-)c(H+)/c(CH3COOH)计算;
C.C点对应的醋酸过量,所以抑制了水的电离;
D.在D点遵循物料守恒和电荷守恒。
A.A、B间任一点,溶液中只存在四种离子有:Na+、H+、CH3COO-、OH-,根据电荷守恒,则有c(Na+)+c(H+)=c(OH-)+c(CH3COO-),溶液显碱性,则有c(OH-)>c(H+),所以溶液中离子浓度大小关系为:c(Na+)>c(OH-)>c(CH3COO-)>c(H+),故A错误;
B.取a所对应的B点进行计算,pH=7,则c(OH-)= c(H+)=10-7mol/L,又根据电荷守恒c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则有c(Na+)=c(CH3COO-),反应后c(CH3COOH)=(0.2a-25×0.1)×10-3/(25+a)×10-3mol/L,则c(Na+)=c(CH3COO-)=(25×0.1)×10-3/(25+a)×10-3mol/L,醋酸的电离平衡常数K=c(CH3COO-)c(H+)/c(CH3COOH)=c(Na+)c(H+)/c(CH3COOH)=2.5×10—7/(0.2a-2.5),故B正确;
C.C点对应的醋酸过量,所以抑制了水的电离,使水电离出的H+浓度小于10-7mol·L-1,故C错误;
D.D点溶液中的醋酸和醋酸钠等量混合,根据在D点的物料守恒,则有c(CH3COO-)+c(CH3COOH)=2c(Na+),根据电荷守恒,则有c(Na+)+c(H+)=c(OH-)+c(CH3COO-),将物料守恒代入电荷守恒式可得c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-),故D错误。
故选D。

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案【题目】中科院一项最新成果实现了甲烷高效生产乙烯,甲烷在催化作用下脱氢,在气相中经自由基偶联反应生成乙烯,其反应如下:2CH4(g)![]() C2H4(g) +2H2(g) △H >0
C2H4(g) +2H2(g) △H >0
化学键 | H—H | C—H | C = C | C—C |
E(kJ / mol) | a | b | c | d |
(1)已知相关化学键的键能如表,甲烷制备乙烯反应的△H =______(用含a.b.c.d的代数式表示)。
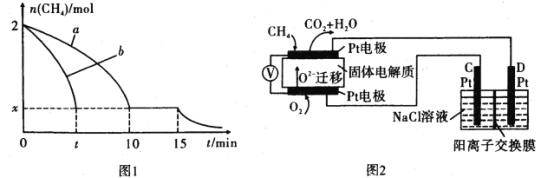
(2)T1温度时,向1L的恒容反应器中充入2 molCH4,仅发生上述反应,反应过程中0~15 min CH4的物质的量随时间变化如图1,测得10-15 min时H2的浓度为1.6molL-1
①0~10min内CH4表示的反应速率为____mol/(Lmin) o
②若图1中曲线a、曲线b分别表示在温度T1时,使用质量相同但表面积不同的催化剂时,达到平衡过程中n (CH4)的变化曲线,其中表示催化剂表面积较大的曲线是____(填“a”或 “b”)。
③15 min时,若改变外界反应条件,导致n( CH4)发生图中所示变化,则改变的条件可能是________(任答一条即可)。
(3)实验测得:v正=K正c2(CH4),v逆=K逆c(C2H4)c2(H2),其中K正、K逆为速率常数仅与温度有关,T1温度时k正与K逆的比值为____(填数值)。若将温度由T1升高到T2,则反应速率增大的倍数V正____V逆(选填“>”、“<”或“=”);判断的理由是__________
(4)科研人员设计了甲烷燃料电池并用于电解。如图2所示,电解质是掺杂了Y2O3与ZrO2的固体,可在高温下传导O2-
①C极的Pt为_____极(选填“阳”或“阴” )。
②该电池工作时负极反应方程式为_______。
③用该电池电解饱和食盐水,一段时间后收集到标况下气体总体积为112 mL,则电解后所得溶液在25℃时pH=_____(假设电解前后NaCl溶液的体积均为500 mL)。