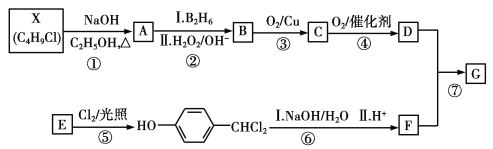
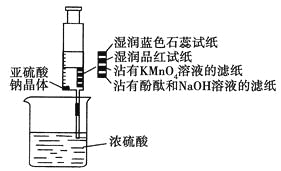
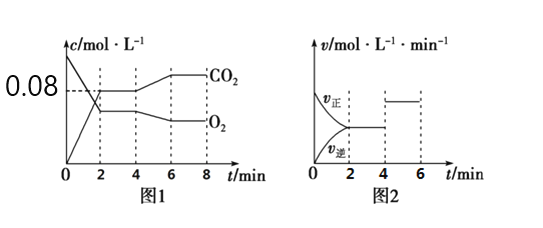
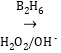题目内容
【题目】根据如图回答问题:
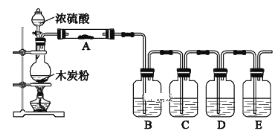
(1)盛装浓硫酸的仪器是___,什么方法证明该装置不漏气?___。
(2)写出浓H2SO4和木炭发生反应的化学方程式:___。如果有0.4mol电子转移,则在标准状况下产生气体___L。
(3)如用图中的装置检验上述反应的全部产物,写出各仪器中应加入的试剂的名称和作用。A中加入的试剂是___,作用是检验产物H2O;B中加入的试剂是品红,褪色现象说明SO2有___性,C中加入的试剂是KMnO4,作用是除去SO2,反应的离子方程式为:___;D中加入的试剂是品红溶液,其作用是___,E中加入的试剂是足量的澄清石灰水,其离子反应方程式是___。
(4)如果将此装置中的木炭粉改为铜,则最左边装置中反应的方程式为___。
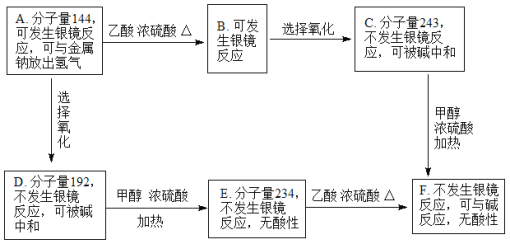
【答案】分液漏斗 改用小火加热烧瓶,若B、C、D、E瓶中有气泡冒出,停止加热后有稳定水柱,则气密性良好 2H2SO4(浓)+C![]() 2H2O+2SO2↑+CO2↑ 6.72 CuSO4或无水硫酸铜 漂白 2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+ 检验SO2是否被完全吸收 CO2+Ca2++2OH-=CaCO3↓+H2O 2H2SO4(浓)+Cu
2H2O+2SO2↑+CO2↑ 6.72 CuSO4或无水硫酸铜 漂白 2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+ 检验SO2是否被完全吸收 CO2+Ca2++2OH-=CaCO3↓+H2O 2H2SO4(浓)+Cu![]() 2H2O+SO2↑+CuSO4
2H2O+SO2↑+CuSO4
【解析】
炭与浓硫酸加热条件下反应产生二氧化碳,二氧化硫和水,检验产物的顺序依次是水、二氧化硫、二氧化碳,相应的检验试剂是无水硫酸铜、品红和澄清石灰水。据此分析解答。
(1)根据装置的构造可是盛装浓硫酸的仪器是分液漏斗;此装置的气密性检验方法是,关闭分液漏斗活塞,微热或小火加热圆底烧瓶,各导管口有气泡冒出,停止加热后各导管形成一段水柱且维持一段时间说明装置气密性良好,
故答案为:分液漏斗;改用小火加热烧瓶,若B、C、D、E瓶中有气泡冒出,停止加热后有稳定水柱,则气密性良好;
(2)炭与浓硫酸加热条件下反应产生二氧化碳,二氧化硫和水,反应方程式为:2H2SO4(浓)+C![]() 2H2O+2SO2↑+CO2↑,反应中C做还原剂,浓硫酸作氧化剂,每1molC反应转移4mol电子,产生2mol二氧化硫和1mol二氧化碳,即4mol电子
2H2O+2SO2↑+CO2↑,反应中C做还原剂,浓硫酸作氧化剂,每1molC反应转移4mol电子,产生2mol二氧化硫和1mol二氧化碳,即4mol电子![]() 3mol气体,0.4mol电子转移,则在标准状况下产生气体为0.3mol,体积为6.72L,
3mol气体,0.4mol电子转移,则在标准状况下产生气体为0.3mol,体积为6.72L,
故答案为:2H2SO4(浓)+C![]() 2H2O+2SO2↑+CO2↑;6.72;
2H2O+2SO2↑+CO2↑;6.72;
(3)炭与浓硫酸产生水、二氧化碳、二氧化硫,要先用无水硫酸铜粉末检验水,即A中应加无水硫酸铜,再用品红溶液检验二氧化硫,二氧化硫有漂白性能使品红褪色,检验完后要除去二氧化硫,可以用溴水或者酸性高锰酸钾除去,所以C中的高锰酸钾是除去二氧化硫,相应的反应为:2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+,为确保二氧化硫出尽在D中应加品红检验二氧化硫是否除尽,最后将剩余气体通入澄清石灰水中检验二氧化碳,发生的反应方程式为: CO2+Ca2++2OH-=CaCO3↓+H2O,
故答案为:无水硫酸铜;漂白;2MnO4-+5SO2+2H2O=2Mn2++5SO42-+4H+;检验SO2是否被完全吸收;CO2+Ca2++2OH-=CaCO3↓+H2O;
(4)如果将此装置中的木炭粉改为铜,则最左边装置中反应铜与浓硫酸加热条件下反应得到硫酸铜、二氧化硫和水,反应方程式为:2H2SO4(浓)+Cu![]() 2H2O+SO2↑+CuSO4,
2H2O+SO2↑+CuSO4,
故答案为:2H2SO4(浓)+Cu![]() 2H2O+SO2↑+CuSO4;
2H2O+SO2↑+CuSO4;

【题目】(12分)下表是元素周期表的一部分,请针对表中所列标号为①~⑩的元素回答下列问题。
| IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
(1)非金属性最强的元素是______(填元素符号,下同),形成化合物种类最多的元素是_______。
(2)第三周期元素除⑩外原子半径最小的是______(填元素符号),这些元素的最高价氧化物对应水化物中碱性最强的是__________(填化学式,下同),具有两性的是____________。
(3)⑤⑥⑦单质的活泼性顺序为______>______>______ (填元素符号),判断的实验依据是________________________________________________(写出一种)。