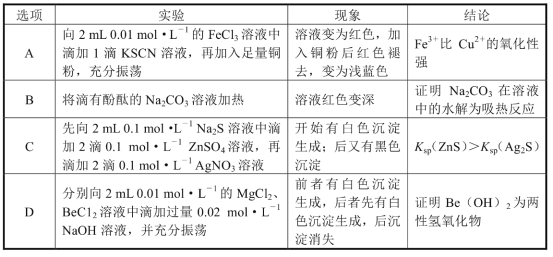
题目内容
【题目】乙二醛(OHC-CHO)是一种重要的精细化工产品。长郡中学高三化学兴趣小组利用乙醛液相硝酸氧化法制备乙二醛并测定乙二醛纯度,装置如图所示。
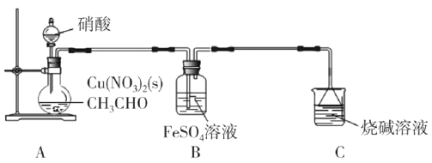
已知:①NO+FeSO4=FeSO4·NO(棕色)。
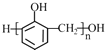
②几种有机物的部分性质如表所示:

实验步骤:
①取20mL的乙醛装于烧瓶,加入2gCu(NO3)2粉末作催化剂,向烧瓶中缓慢滴加2mol·L-1硝酸至乙醛完全反应为止;
②提纯产品,最终得到10.0mL产品。
请回答下列问题:
(1)盛装硝酸的仪器名称是__。
(2)实验中,观察到装置B中溶液变为棕色,制备乙二醛的化学方程式为__。
(3)向烧瓶中滴加硝酸要“缓慢”,其目的是__;判断烧瓶中制备乙二醛的反应已完成的标志是__。
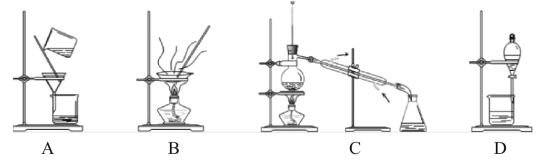
(4)分离提纯产品,宜选择下列装置__(填字母)。
(5)根据上述实验数据,该实验中乙二醛的产率约为__(填字母)。
a.56.5% b.61.8% c.67.9% d.72.6%
(6)实验室可用酸性KMnO4溶液测定乙二醛的纯度,发生反应的离子方程式为:18H++6MnO4-+5C2H2O2→10CO2↑+6Mn2++14H2O。实验步骤如下:取VmL产品,加蒸馏水稀释至250mL,量取25.00mL稀释后的溶液于锥形瓶,滴加5.00mL稀硫酸,用cmol·L-1KMnO4溶液,三次平行实验消耗KMnO4溶液体积如下:
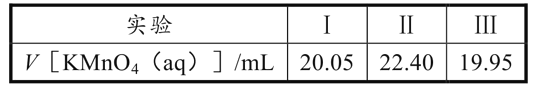
滴定终点的标志是__;该产品纯度为___g·mL-1(用含V和c的代数式表示)。
【答案】分液漏斗 3CH3CHO+4HNO3![]() 3OHC-CHO+4NO
3OHC-CHO+4NO![]() +5H2O 防止乙二醛被氧化 当A中烧瓶不再产生气泡 C b 当滴入最后一滴KMnO4溶液,溶液由无色变为紫红色且半分钟不褪色
+5H2O 防止乙二醛被氧化 当A中烧瓶不再产生气泡 C b 当滴入最后一滴KMnO4溶液,溶液由无色变为紫红色且半分钟不褪色 ![]()
【解析】
该实验的目的是制备乙二醛并测定乙二醛纯度,制备乙二醛的原理是用硝酸氧化乙醛,用FeSO4检验生成的气体NO,烧碱溶液进行尾气处理;在分离提纯产物时,根据表格中的乙二醛与其他几种有机物的物理性质差异,只能用蒸馏法分离;在计算产率时,先计算理论产量,再计算实际产量,产率=![]() ;在用酸性KMnO4溶液测定乙二醛的纯度时,因为酸性KMnO4溶液本身有颜色,故不需要其他的指示剂,在计算时先根据化学方程式计算出乙二醛的量,再计算纯度。
;在用酸性KMnO4溶液测定乙二醛的纯度时,因为酸性KMnO4溶液本身有颜色,故不需要其他的指示剂,在计算时先根据化学方程式计算出乙二醛的量,再计算纯度。
(1)实验装置图中盛装硝酸的仪器是分液漏斗,故答案为:分液漏斗;
(2)观察到装置B中溶液变为棕色,说明硝酸的还原产物为NO,化学方程式为:3CH3CHO+4HNO3![]() 3OHC-CHO+4NO
3OHC-CHO+4NO![]() +5H2O,故答案为:3CH3CHO+4HNO3
+5H2O,故答案为:3CH3CHO+4HNO3![]() 3OHC-CHO+4NO
3OHC-CHO+4NO![]() +5H2O;
+5H2O;
(3)要缓慢加入硝酸的原因是防止乙二醛被氧化,当A中烧瓶不再产生气泡时,说明反应已经完成,故答案为:防止乙二醛被氧化;当A中烧瓶不再产生气泡;
(4)根据表格中的乙二醛与其他几种有机物的物理性质差异,只能用蒸馏法分离,故答案为:C;
(5)n(乙醛)=![]() =0.355mol,由方程式可知n(乙二醛)= n(乙醛)=0.354mol,理论上生成的m(乙二醛)=0.354mol
=0.355mol,由方程式可知n(乙二醛)= n(乙醛)=0.354mol,理论上生成的m(乙二醛)=0.354mol![]() 58g/mol=20.53g,乙二醛的实际产量=10.0mL
58g/mol=20.53g,乙二醛的实际产量=10.0mL![]() 1.27g/mL=12.7g,产率=
1.27g/mL=12.7g,产率=![]() =
=![]()
![]() 61.8%,答案为:b;
61.8%,答案为:b;
(6)用酸性KMnO4溶液测定乙二醛的纯度,即用酸性KMnO4溶液滴定乙二醛溶液,由于酸性KMnO4溶液本身有颜色,故不需要其他的指示剂,当滴入最后一滴KMnO4溶液,溶液由无色变为紫红色且半分钟不褪色,说明到达滴定终点;根据方程式找到关系式:6MnO4-![]() 5C2H2O2,表4的数据中,第II次数据偏差较大,应该舍去,故用去的KMnO4溶液的体积平均值为20.00mL,计算出n(MnO4-)=0.02c mol,则n(C2H2O2)=
5C2H2O2,表4的数据中,第II次数据偏差较大,应该舍去,故用去的KMnO4溶液的体积平均值为20.00mL,计算出n(MnO4-)=0.02c mol,则n(C2H2O2)=![]()
![]() 0.02c mol,原VmL的产品中含有的n(C2H2O2)=
0.02c mol,原VmL的产品中含有的n(C2H2O2)=![]()
![]() 0.02c
0.02c![]() 10 mol=
10 mol=![]() mol,算出产品的纯度为=
mol,算出产品的纯度为=![]() =
=![]() g·mL-1,故答案为:当滴入最后一滴KMnO4溶液,溶液由无色变为紫红色且半分钟不褪色;
g·mL-1,故答案为:当滴入最后一滴KMnO4溶液,溶液由无色变为紫红色且半分钟不褪色;![]() 。
。

 提分百分百检测卷单元期末测试卷系列答案
提分百分百检测卷单元期末测试卷系列答案 小学期末标准试卷系列答案
小学期末标准试卷系列答案【题目】下列我国科研成果所涉及材料中,主要成分为同主族元素形成的无机非金属材料的是
|
|
|
|
A.4.03米大口径碳化硅反射镜 | B.2022年冬奥会聚氨酯速滑服 | C.能屏蔽电磁波的碳包覆银纳米线 | D.“玉兔二号”钛合金筛网轮 |
A. AB. BC. CD. D