题目内容
硫酸铅(PbSO4)广泛应用于制造蓄电池、白色颜料等。利用锌冶炼过程中的铅浮渣生产PbSO4的流程如下:
已知铅浮渣的主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质。25℃时,Ksp(CaSO4)=4.9x10-5,Ksp(PbSO4)=1.6xl0-8。
(1)已知步骤I有NO气体产生,浸出液中含量最多的阳离子是Pb2+。分别写出PbO、Pb参加反应的化学方程式 。
(2)步骤I需控制硝酸的用量并使Pb稍有剩佘,目的是 。
(3)母液可循环利用于步骤I,其溶质主要是 (填一种物质化学式),若母液中残留的SO42-过多,循环利用时可能出现的问题是 。
(4)产品PbSO4还需用Pb(NO3)2溶液多次洗涤,目的是除去 。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为 。
(1)PbO+2HNO3=Pb(NO3)2+H2O (2分)
3Pb+8HNO3=3Pb(NO3)2+2NO↑+4H2O (3分)
(2)防止Ag被溶解进入溶液 (或使Ag留在浸出渣中)(2分)
(3)HNO3 (2分) 浸出时部分铅离子生成PbSO4随浸出渣排出,降低PbSO4的产率 (2分)
(4)CaSO4杂质 (2分)
(5))PbSO4+2e-=Pb+SO42- (2分)
解析试题分析:(1)写方程式时注意,Pb的二价稳定,Pb与HNO3发生氧化还原反应生成NO。
(2)Pb过量可将溶解的Ag置换出来,防止Ag+进入溶液。
(3)母液循环利用,第一步需要加入HNO3,因此母液中溶质主要是HNO3。根据题意PbSO4难溶于水,若硫酸根过多,则会使部分Pb生成PbSO4随浸出渣排出,产率降低。
(4)产品中含有的主要杂质是CaSO4,根据沉淀转化原理,加入Pb(NO3)2溶液可使CaSO4转化为Ca(NO3)2,除去杂质。
(5)根据铅蓄电池原理,负极的Pb充电时接电源负极,成为电解池的阴极,因此阴极的反应式为PbSO4+2e-=Pb+SO42-。
考点:考查工艺流程分析,方程式书写,电解池电极反应式书写。

 名校课堂系列答案
名校课堂系列答案回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图:
(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式 。
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是 。实验室蒸馏操作时常用的玻璃仪器有:酒精灯、蒸馏烧瓶、 、 、接收管、锥形瓶等。
(3)GeCl4水解生成GeO2·nH2O,此过程用化学方程式可表示为 。
温度对GeCl4的水解率产生的影响如图1所示,其原因是 。 为控制最佳的反应温度,实验时可采取的措施为 (填序号)。
A.用冰水混合物 B.49℃水浴 C.用冰盐水
(4)结合Ge在元素周期表中的位置及“对角线”法则,分析GeO2溶解率随pH 变化的原因 ,用离子方程式表示pH>8时GeO2溶解率增大可能发生的反应 。
| pH | 4 | 5 | 6 | 7 | 8 | 9 |
| 溶解率/% | 47.60 | 32.53 | 11.19 | 5.27 | 1.96 | 8.85 |
以地下卤水(主要含NaCl,还有少量Ca2+、Mg2+)为主要原料生产亚硫酸钠的新工艺如下,同时能得到用作化肥的副产品氯化铵。
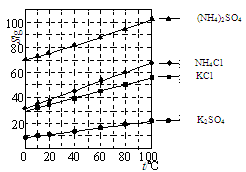
已知以下四种物质的溶解度曲线图:
(1)“除杂”时,先加入适量石灰乳过滤除去Mg2+,再通入CO2并用少量氨水调节pH过滤除去Ca2+,“废渣”的主要成分为 、 。
(2)“滤渣1”的化学式为 。
(3)在“滤液1”中加入盐酸的目的是 。“滤渣2”的化学式为 。
(4)已知H2CO3和H2SO3的电离常数如下表,“通入SO2”反应的化学方程式为 。
| 物质 | 电离常数(25℃) |
| H2CO3 | K1=4.4X10-7 K2=4.7X10-11 |
| H2SO3 | K1=1.23X10-2 K2=5.6X10-8 |
化学工业是国民经济的支柱产业.下列生产过程中不涉及化学变化的是
| A.氮肥厂用氢气和氮气合成氨 | B.钢铁厂用热还原法冶炼铁 |
| C.硫酸厂用接触法生产硫酸 | D.炼油厂用分馏法生产汽油 |
一包硫酸铵样品中,不慎混入了下列化肥:①氯化铵;②碳酸氢铵;③硝酸钾;④尿素[CO(NH2)2]中的一种。经测定,这种硫酸铵样品中含N的质量分数为23%,则混入的杂质可能是 ( )。
| A.①或② | B.①或④ |
| C.①或②或③ | D.②或③或④ |

 )可制备Fe2O3。根据流程回答下列问题:
)可制备Fe2O3。根据流程回答下列问题:
 LiF↓,该反应的平衡常数表达式为K= 。
LiF↓,该反应的平衡常数表达式为K= 。