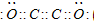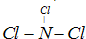题目内容
现有A、B、C、D、E五种有机物,它们的组成都是含碳40%、氢6.7%、氧53.3%。又知:①A对H2的相对密度为15,其水溶液能发生银镜反应;②B分子中共有24个原子,B与C互为同分异构体,B和C都是有甜味的白色晶体,但C比B更甜;③D与E的蒸气密度为2.68 g·L-1(标准状况),D具有酸性,E能水解得醇和酸。试写出A、B、C、D、E的结构简式和名称。
解析:根据有机物中C、H、O的质量分数相同,知实验式相同;分子中原子个数比为![]() =1∶2∶1,实验式为CH2O,相对分子质量为30。A的相对分子质量:15×2=30,分子式:CH2O,根据能发生银镜反应的性质可判断A为甲醛CH2O,B、C互为同分异构体,均有24个原子:24÷4=6,即B、C分子式为C6H12O6,根据C比B更甜,可判断B为葡萄糖,C为果糖,根据D、E蒸气密度(标准状况下)可以计算D、E的相对分子质量为60。因为
=1∶2∶1,实验式为CH2O,相对分子质量为30。A的相对分子质量:15×2=30,分子式:CH2O,根据能发生银镜反应的性质可判断A为甲醛CH2O,B、C互为同分异构体,均有24个原子:24÷4=6,即B、C分子式为C6H12O6,根据C比B更甜,可判断B为葡萄糖,C为果糖,根据D、E蒸气密度(标准状况下)可以计算D、E的相对分子质量为60。因为![]() =2,所以D、E分子式为C2H4O2,根据性质可判断D为乙酸,E为甲酸甲酯。
=2,所以D、E分子式为C2H4O2,根据性质可判断D为乙酸,E为甲酸甲酯。
答案:A.HCHO甲醛
B.CH2OH(CHOH)4—CHO葡萄糖
![]()
D.CH3COOH乙酸
E.HCOOCH3甲酸甲酯

练习册系列答案
相关题目
 现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E的氢化物分子构型都是V型.A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态.