��Ŀ����
����Ŀ����ѡ��3�����ʵĽṹ�����ʡ���.��Ԫ���ǵ縺�����ķǽ���Ԫ�أ��ҷ�ԭ�ӵİ뾶С����˷����ʼ��ͽ������ʷ�Ӧ�Ұ��������������̬����MnF7 ��VF5 ��CaF2 �ȡ���Ԫ�ػ����Ժ���Ԫ���γɷ������OF2 �ȡ�
��ش��������⣺

��1��Vԭ�ӵĺ�������Ų�ʽΪ ����ͼ��ʾһ����������CaF2 ��������ͼ��ʵ�����ʾ (�F-��Ca2+ )�� �辧���߳�Ϊa���������F-��Ca2+֮��ľ���Ϊ (�ú�a�Ĵ���ʽ��ʾ)��
��2��OF2 ��������ԭ�ӵĹ���ӻ�����Ϊ ��OF2����Ϊ�������������Ϊ�������ԭ���� ��
��.��ͭ�ڹ�ҵ����Ҫ�������쵼�ߡ�����Ԫ���ȣ�ͭ���γ�+1��+2�Ļ�����ش��������⣺
��3��д����̬Cu+ �ĺ�������Ų�ʽ ��C��N��O����Ԫ�صĵ�һ�������ɴ�С��˳���� ��
��4����ͼ��ʾ��ͭ��ij��������ľ���ʾ��ͼ����������Ļ�ѧʽΪ ��
��5��������ͭ��Һ�еμӰ�ˮ��������ɫ�������ڵμӰ�ˮ��������ȫ���ܽ�ʱ�ɵõ���ɫ��Һ�����������м��뼫�Խ�С���Ҵ�������������ɫ��[Cu(NH3)4]SO4��H2O������������ɫ�����е�NH3ͨ��������������Cu2+��ϡ�NH3�����е�Nԭ���ӻ���ʽ�� ����NH3���ӻ�Ϊ�ȵ������һ������ (��дһ��)
���𰸡���1��1s22s22p63s23p63d34s2 ��[Ar]3d34s2 (2��)Ca2+ (1��)![]() (3 �� )
(3 �� )
��2��sp3�ӻ�(1��) ����������Ԫ���Ը��ۣ�����OF2����Ԫ�صĻ����Ϊ+2 (1��)
II����3��ls22s22p63s23p63d10��Ar��3d10(2��) N��O��C (1��)
��4��CuO (1��) ��5����λ(1��) sp3�ӻ� (1��) H3O+��(1��)
��������
�����������1��Vԭ����23�ţ����������Ų�ʽΪ1s22s22p63s23p63d34s2(��[Ar]3d34s2)��CaF2�����У��������ĿΪ8��1/8+6��1/2=4������ȫ���ھ����ڲ�����ĿΪ8����ͼ�а����Ǹ����ӣ��Ѿ����ֳ�8��С����������ͼ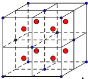 ����F-λ��С����������ģ���С������Ca2+��F-֮����������ΪС���������Խ��ߵ�һ�룬��֪�����߳�Ϊa����С������ı߳�Ϊa/2����Ca2+��F-֮����������Ϊx��
����F-λ��С����������ģ���С������Ca2+��F-֮����������ΪС���������Խ��ߵ�һ�룬��֪�����߳�Ϊa����С������ı߳�Ϊa/2����Ca2+��F-֮����������Ϊx��
��(a/2)2+(a/2)2+(a/2)2=x2�����x=![]() ��
��
��2��OF2��������ԭ��Ϊ2+(6-2��1)/2=4������sp3�ӻ���OF2��FԪ��Ϊ-1�ۣ�OԪ�صĻ��ϼ�Ϊ+2�ۣ�����������OԪ�صĻ��ϼ�Ϊ-2�ۣ�����OF2����Ϊ�����
��3��Cu��ԭ������Ϊ29���۵����Ų�Ϊ3d104s1�����̬Cu+�ĺ�������Ų�ʽΪ ls22s22p63s23p63d10��Ar��3d10��C��O��NԪ�ض��ǵڶ����ڷǽ���Ԫ�أ�ͬһ����Ԫ��������ҵ�һ�����ܳ��������ƣ���NԪ��ԭ��2p�ܼ��ǰ����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ��ʵ�һ������N��O��C��
��4���ɾ���ʾ��ͼ��֪��1����������4��A��BΪ8��1/8+6��1/2=4����ԭ�Ӹ���֮��Ϊ1��1����������Ļ�ѧʽΪCuO��
��5��NH3��Nԭ���ṩ�¶Ե��ӣ�Cu2+�ṩ�չ���������γ���λ����NH3�����й¶Ե�����Ϊ1���ɼ���Ϊ3����Nԭ�ӵ��ӻ���ʽΪsp3����NH3���ӻ�Ϊ�ȵ������һ����������ͬ�ļ۵�����8��ԭ����4����ΪPH3��H3O+�ȡ�



